Механизм действия/фармакодинамика
Рекомбинантная человеческая ДНаза (дорназа альфа) – генно-инженерный вариант человеческого природного фермента, который расщепляет внеклеточную ДНК.
Накопление вязкого гнойного секрета в дыхательных путях приводит к нарушению функции легких и появлению инфекций. Гнойный секрет содержит очень высокие концентрации внеклеточной ДНК − вязкого полианиона, высвобождающегося из разрушающихся лейкоцитов, которые накапливаются в ответ на инфекцию. In vitro дорназа альфа гидролизирует ДНК в мокроте и значительно уменьшает вязкость мокроты у пациентов с кистозным фиброзом.
Ингаляция дорназы альфа in vivo улучшает функцию легких и снижает частоту обострений при кистозном фиброзе, при этом дыхательные пути лучше освобождаются от секрета и слизи.
Клинические исследования эффективности
Препарат Пульмозим® исследовался у пациентов с кистозным фиброзом старше 5 лет и с различной степенью тяжести легочного заболевания. Большинство исследований были двойные слепые и плацебо-контролируемые. Все пациенты получали лечение по назначению лечащих врачей.
Пациенты старше 5 лет с ФЖЕЛ > 40% от нормы
Препарат Пульмозим® 2.5 мг один или два раза в день ежедневно, введенный посредством небулайзера Hudson Т Up-draft II с компрессором Pulmo-Aide, снижал частоту первой инфекции дыхательных путей (инфекции, которая требует парентерального применения антибиотиков) и улучшал средний ОФВ
1 (объем форсированного выдоха за 1 секунду) по сравнению с плацебо.
Препарат Пульмозим® при однократном или двукратном ежедневном приеме снижал относительный риск обострения инфекции дыхательных путей на 27% или 29% (см. Таблицу 1). Субанализ данных показал, что эффект препарата Пульмозим® в отношении обострения инфекций у старших пациентов (старше 21 года) меньше; этим пациентам может потребоваться режим дозирования два раза в день. Пациенты с исходной ФЖЕЛ > 85% могут получить положительный эффект от двукратной ежедневной дозы (см. Таблицу 1). Пониженный риск обострения инфекций у пациентов, получавших лечение препаратом Пульмозим®, сохранялся в течение шестимесячного исследования и не коррелировал непосредственно с улучшением ОФВ
1 в течение первых двух недель терапии.
Таблица 1. Частота возникновения первой инфекции дыхательных путей, что обусловливает необходимость парентерального введения антибиотиков в контролируемом исследовании.
|
|
Плацебо
n=325
|
2.5 мг однократно ежедневно
n=322
|
2.5 мг двукратно ежедневно
n=321
|
|
Процент пациенток с инфекцией
|
43%
|
37%
|
33%
|
|
Относительный риск (против плацебо)
|
|
0.73
|
0.71
|
|
р-значение (против плацебо)
|
|
0.015
|
0.007
|
|
Субгруппы по возрасту и исходной ФЖЕЛ
|
Плацебо (n)
|
2.5 мг однократно ежедневно (n)
|
2.5 мг двукратно ежедневно (n)
|
|
Возраст
|
|
|
|
|
5 – 20 лет
|
42% (201)
|
25% (199)
|
28% (184)
|
|
21 лет и старше
|
44% (124)
|
48% (123)
|
39% (137)
|
|
Исходная ФЖЕЛ
|
|
|
|
|
40-85% от нормы
|
54% (194)
|
41% (201)
|
44% (203)
|
|
> 85% от нормы
|
27% (131)
|
21% (121)
|
14% (118)
|
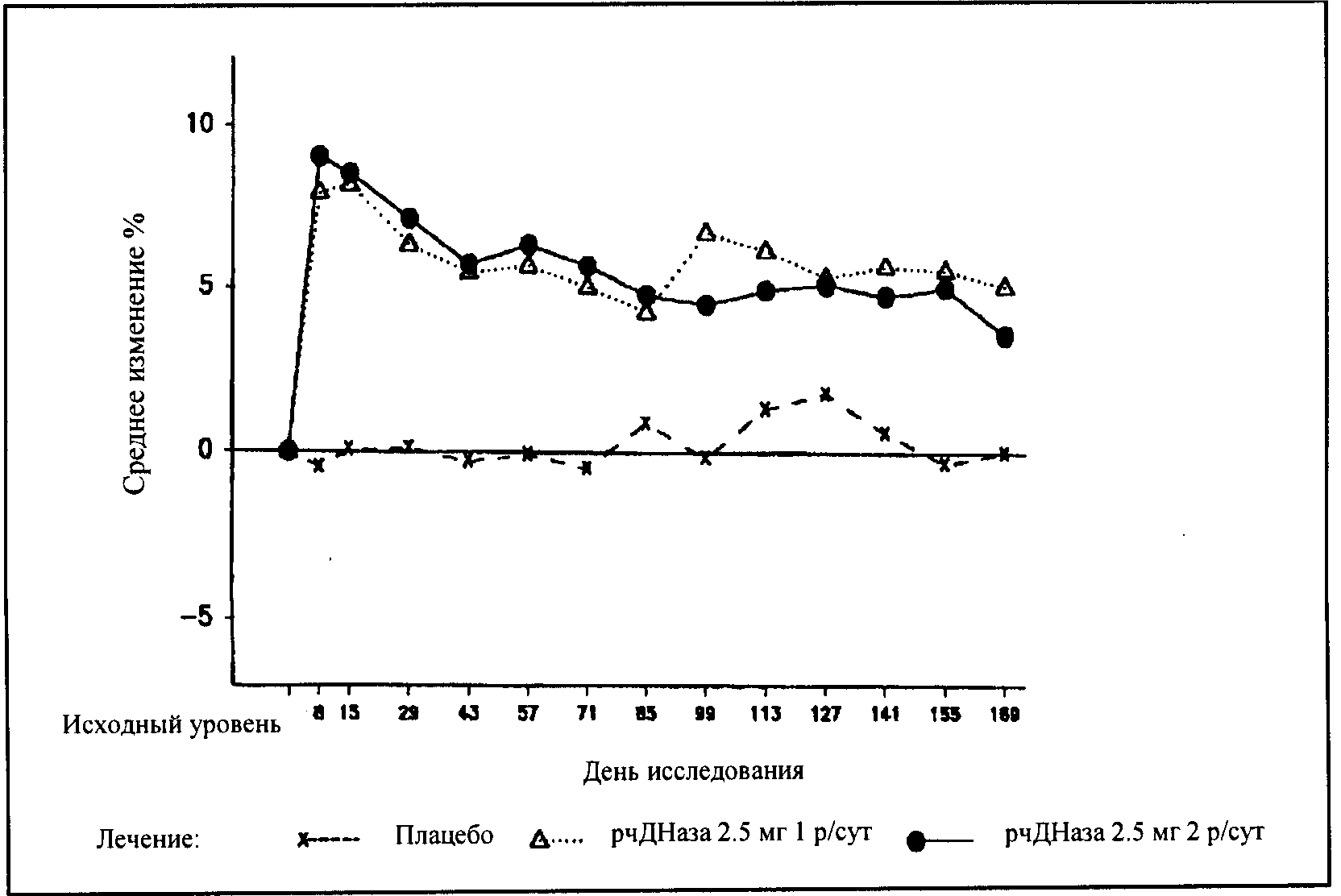
В течении первых восьми дней после начала терапии препаратом Пульмозим® однократно или двукратно ежедневно среднее значение ОФВ
1 улучшилось на 7,9% или 9,0%, соответственно, по сравнению с исходным значением. После терапии в течение шести месяцев улчшение ОФВ
1 составило 5,8% или 5,6% по сравнению с исходным значением при однократной или двукратной ежедневной дозировке. У пациентов, получавших плацебо, значительных изменений в показателях легочной функции в период исследования не выявлено (см. Рисунок 1).
Рисунок 1. Среднее изменение ОФВ1 в % от исходного уровня у пациентов старше 5 лет с ФЖЕЛ > 40% от нормы.
 Пациенты младше 5 лет
Пациенты младше 5 лет
Фармакокинетические данные исследования 65 детей в возрасте от 3 месяцев до 5 лет и 33 детей в возрасте от 5 до 10 лет показывают, что при введении 2.5 мг препарата Пульмозим® посредством небулайзера Pari Baby и компрессора Proneb (= PariBoy) у пациентов младше 5 лет наблюдали такие же концентрации ДНазы в легких, как и при применении небулайзера Pari LC Plus Vemebler и такого же компрессора у старших детей, которые ответили на лечение препаратом Пульмозим® (см. «Фармакокинетика у особых групп пациентов»).
Для обеспечения безопасности в данной популяции пациентов см. раздел «Побочные действия».
Эффективность препарата Пульмозим® у детей в возрасте до 5 лет не изучалась.
Фармакокинетика
Результаты доклинических исследований
Всасывание
Ингаляционные исследования на крысах и обезьянах показали, что лишь небольшая часть дорназы альфа всасывается системно (< 15% у крыс и < 2% у обезьян). В соответствии с этими исследованиями на животных обнаружено, что дорназа альфа, которую пациент получает в виде аэрозоля для ингаляции, системно всасывается в незначительном количестве.
После перорального введения крысам всасывание дорназы альфа из желудочно-кишечного тракта является незначительным.
Распределение/Выведение
Исследования на крысах и обезьянах показали, что препарат Пульмозим® после внутривенного введения быстро выводится из сыворотки. В этих исследованиях начальный объем распределения примерно соответствовал объему сыворотки.
Исследования на крысах показывают, что после введения аэрозоля дорназа альфа выводится из легких с периодом полувыведения 11 часов.
В настоящее время фармакокинетические данные для очень молодых или старых животных отсутствуют.
Результаты клинических исследований
Всасывание
В норме ДНаза присутствует в сыворотке крови человека. Ингаляция дорназы альфа в дозах до 40 мг в течение 6 дней не приводила к существенному увеличению концентрации ДНазы в сыворотке крови по сравнению с нормальными эндогенными уровнями. Сывороточная концентрация ДНазы не превышала 10 нг/мл. После назначения дорназы альфа по 2.5 мг два раза в сутки на протяжении 24 недель средние сывороточные концентрации ДНазы не отличались от средних показателей до лечения (3.5±0.1 нг/мл), что свидетельствует о низком системном всасывании или малой аккумуляции (см. ниже раздел «Доклинические данные»).
Распределение
У больных с кистозным фиброзом средняя концентрация дорназы альфа в мокроте через 15 минут после ингаляции 2.5 мг достигала примерно 3 мкг/мл. После ингаляции концентрация дорназы альфа в мокроте быстро уменьшается.
Метаболизм
Считается, что дорназа альфа метаболизируется под действием протеаз, присутствующих в биологических жидкостях.
Выведение
Исследования на людях показывают, что после внутривенного введения дорназы альфа период полувыведения из сыворотки крови составляет 3-4 часа. Исследования на крысах и обезьянах показали, что ДНаза после внутривенного введения быстро выводится из сыворотки.
После введения аэрозоля крысам дорназа альфа выводилась из легких с периодом полувыведения 11 часов.
В течение 2 часов значение концентрации ДНазы в мокроте снижается менее чем в два раза по сравнению со значением сразу после ингаляции, однако действие на реологию мокроты сохраняется более 12 часов.
Фармакокинетика у особых групп пациентов
Проводилось открытое двухнедельное исследование препарата Пульмозим® у пациентов с кистозным фиброзом в возрасте от 3 месяцев до 9 лет. Препарат Пульмозим® в дозе 2.5 мг вводился ингаляционного ежедневно 98 пациентам (из них 65 пациентов в возрасте от 3 месяцев и < 5 лет, а также 33 пациента в возрасте от 5 и < 10 лет). В течение 90 минут после первой ингаляции проводился бронхоальвеолярный лаваж (БАЛ). Небулайзер Pari Baby (при котором используется маска вместо мундштука) использовался у пациентов, которые не могли в период ингаляции вдыхать и выдыхать через рот (54 из 65 (83%) младших и 2 из 33 (6%) старших пациентов). Концентрация ДНазы в жидкости БАЛ достигла детектируемого уровня у всех пациентов, но варьировала в широком диапазоне от 0.007 до 1.8 мкг/мл. После применения препарата Пульмозим® в течение в среднем 14 дней концентрация ДНазы в сыворотке крови (среднее значение ± стандартное отклонение) повышалась на 1.1±1.6 нг/мл у детей от 3 месяцев до < 5 лет и на 0.8±1.2 нг/мл у детей от 5 до < 10 лет.
Доклинические данные
Канцерогенность
Двухлетнее исследование на крысах не обнаружило никаких доказательств онкогенного потенциала при введении путем ингаляции.
У групп 60 крыс каждого пола дорназа альфа вводилась в течение 2 лет в дозах 51, 101 или 246 мкг/кг/день в нижний отдел респираторного тракта. Две контрольные группы сопоставимого размера получали воздух или растворитель, соответственно. Дорназа альфа хорошо переносилась. Не было выявлено опухолей необычного типа и не отмечалось увеличения развития опухолей, которые можно было бы объяснить онкогенностью дорназы альфа в дыхательном тракте, других органах или тканях крыс.
Мутагенность
В тесте Эймса, тесте на клетках лимфомы мышей, тесте на аберрации хромосом в культивированных лимфоцитах периферической крови человека и в микроядерном тесте на мышах признаков генотоксического потенциала не выявлено.
Нарушения фертильности
Исследования дорназы альфа не свидетельствовали о нарушении фертильности, тератогенности или влиянии препарата на развитие плода у животных.
Тератогенность
У кроликов и грызунов исследования дорназы альфа не выявили никаких признаков нарушения фертильности и тератогенности.
Другие исследования
У лактирующих яванских макак, получавших высокие дозы дорназы альфа внутривенно (100 мкг/кг однократная доза, за которой последовало 80 мкг/кг/час на 6 часов), были обнаружены низкие концентрации дорназы альфа в материнском молоке (< 0.1% от сывороточных концентраций).
Четырехнедельное исследование по ингаляционной токсичности было начато в отношении крыс через 22 дня после рождения в дозах 0, 51, 102 и 260 мкг/кг/сут. Дорназа альфа хорошо переносилась. В дыхательном тракте поражений обнаружено не было.
Дополнительная информация
Несовместимость
Препарат Пульмозим® представляет собой водный раствор без буферных свойств. Препарат Пульмозим® нельзя разводить или смешивать с другими препаратами или растворами. Смешивание препарата с другими лекарственными средствами может привести к нежелательным структурным и/или функциональным изменениям препарата Пульмозим® или другого компонента смеси.