Визкью, раствор, 120 мг / 1 мл 0.23 мл ×1
для внутриглазного введения, Новартис Фарма, Швейцария • По рецепту
Минск
Каталог
МНН: Бролуцизумаб
ФТГ: Мибп
Цены в аптеках: Минск
Что из себя представляет препарат Визкью™
Визкью™ содержит активное вещество бролуцизумаб, которое относится к группе антинеоваскуляризационных лекарственных препаратов. Визкью™ вводится врачом в глаз для лечения офтальмологических заболеваний, которые могут повлиять на Ваше зрение.
Для чего применяется Визкью™
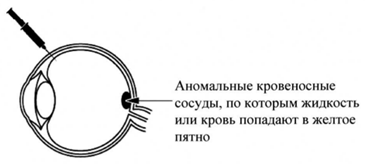
Визкью™ применяется для лечения заболеваний глаз у взрослых, которые возникают, при образовании и росте аномальных кровеносных сосудов под желтым пятном (макулой). Макула, расположенная в задней части глаза, отвечает за четкость зрения. Аномальные кровеносные сосуды могут пропускать жидкость или кровь в глаз и влиять на функцию макулы, что приводит к возникновению следующих заболеваний, приводящих к ухудшению зрения:
Как действует Визкью™
Вещество, называемое фактором роста эндотелия сосудов А (VEGF А), вызывает рост кровеносных сосудов в глазу. Присоединяясь к VEGF А, Визкью™ блокирует его действие и, таким образом, уменьшает рост аномальных кровеносных сосудов при ВМД, что, в свою очередь, уменьшает проникновение жидкости или крови в глаз.
Визкью™ может замедлить прогрессирование заболевания и тем самым сохранить или даже улучшить Ваше зрение.
- если у Вас аллергия на бролуцизумаб или какие-либо другие компоненты данного лекарственного препарата, перечисленные в разделе «Состав»;
- если у Вас активная инфекция глаза или области вокруг глаза, а также если есть подозрение на глазную инфекцию;
- если у Вас наблюдается боль или покраснение в глазу (воспаление глаза).
При наличии любого из этих состояний проконсультируйтесь с врачом.
Визкью™ при этом применять не следует.
Проконсультируйтесь с врачом, прежде чем применять Визкью™, если что-либо из следующего относится к Вам:
- если у Вас глаукома (заболевание глаз, обычно вызываемое высоким давлением в глазу);
- если Вы ранее наблюдали вспышки света или темные плавающие помутнения (пятна) в глазах, и если размер и количество плавающих пятен внезапно увеличивается;
- если Вы перенесли операцию на глазу в течение последних 4-х недель или если такая операция планируется в последующие 4 недели;
- если у Вас когда-либо были любые заболевания глаз или проводились офтальмологические процедуры;
- если в течение последнего года у Вас возникала внезапная потеря зрения из-за закупорки кровеносных сосудов в задней части глаза (окклюзия сосудов сетчатки) или воспаления кровеносных сосудов в задней части глаза (васкулит сетчатки).
Немедленно проконсультируйтесь с врачом, если у Вас возникает:
- покраснение глаз, боль в глазах, усиление дискомфорта, усиление покраснения глаз, нечеткость или снижение зрения, увеличение количества мелких частиц в области зрения, повышенная чувствительность к свету;
- внезапная потеря зрения, что может быть признаком окклюзии сосудов сетчатки.
При появлении любого из вышеперечисленных симптомов Ваш врач может прекратить лечение препаратом Визкью™.
Кроме того, вам следует знать, что:
- безопасность и эффективность Визкью™ при одновременном введении в оба глаза не изучались, и использование таким образом может привести к повышенному риску возникновения нежелательных реакций;
- у некоторых пациентов инъекции Визкью™ могут вызвать повышение внутриглазного давления в течение 30 минут после введения. Ваш врач будет контролировать это после каждой инъекции;
- врач проверит наличие у Вас других факторов риска, которые могут увеличить вероятность разрыва или отслоения одного из слоев в задней части глаза (отслоение или разрыв сетчатки, а также отслоение или разрыв пигментного эпителия сетчатки). В этом случае лечение Визкью™ следует проводить с осторожностью.
Системное использование ингибиторов VEGF - веществ, аналогичных содержащимся в Визкью™, - потенциально связано с риском тромбоза, блокирующего кровеносные сосуды (артериальной тромбоэмболии), что может привести к сердечному приступу или инсульту. Существует теоретический риск таких явлений после введения Визкью™ в глаз.
Дети и подростки
Визкью™ не применяют у детей и подростков в возрасте до 18 лет.
Содержание натрия
Данный лекарственный препарат содержит менее 1 ммоль натрия (23 мг) на дозу, то есть практически не содержит натрий.
Содержание полисорбата
Лекарственный препарат содержит полисорбат 80 в количестве 0,01 мг на дозу (0,05 мл). Полисорбаты могут вызывать аллергические реакции. Сообщите своему врачу, если у вас есть какие-либо известные аллергии.
Проконсультируйтесь с врачом, если Вы используете, недавно использовали или собираетесь использовать какие-либо другие лекарственные препараты.
Если Вы беременны или кормите грудью, предполагаете, что можете быть беременны или планируете беременность, проконсультируйтесь с врачом перед применением данного препарата.
Кормление грудью не рекомендуется во время и в течение как минимум одного месяца после прекращения лечения Визкью™, поскольку неизвестно, проникает ли данный препарат в грудное молоко.
Женщины, которые могут забеременеть, должны использовать эффективный метод контрацепции во время лечения, а также в течение как минимум одного месяца после прекращения лечения препаратом Визкью™. Если во время лечения Вы забеременели или предполагаете, что беременны, немедленно проконсультируйтесь с врачом. Визкью™ не следует применять во время беременности, за исключением случаев, когда потенциальная польза превышает потенциальный риск для будущего ребенка.
После введения Визкью™ у Вас могут возникнуть временные нарушения зрения (например, помутнение зрения). Пока эти явления не исчезнут, Вам не следует управлять транспортным средством и работать с механизмами.
В каком количестве и как часто применять Визкью™
Рекомендуемая доза составляет 6 мг бролуцизумаба.
Влажная ВМД
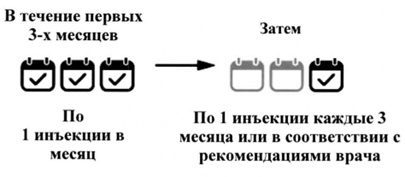
- Вы будете получать по одной инъекции каждый месяц в течение первых 3-х месяцев.
- После этого Вам могут делать по одной инъекции каждые 3 месяца. Ваш врач определит интервал лечения в зависимости от состояния Вашего глаза. Некоторым пациентам может потребоваться лечение каждые 2 месяца. Интервал лечения между двумя дозами Визкью™ должен быть не менее 2 месяцев.
ДМО
- Вы будете получать по одной инъекции каждые шесть недель для первых пяти инъекций.
- После этого Вам могут делать по одной инъекции каждые 3 месяца. Ваш врач определит интервал лечения в зависимости от состояния Вашего глаза. Некоторым пациентам может потребоваться лечение каждые 2 месяца.
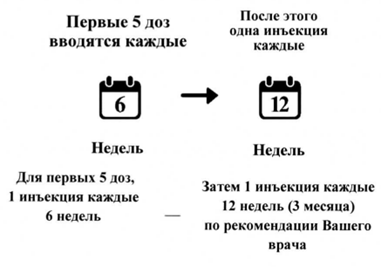
Способ применения
Визкью™ вводится офтальмологом в виде инъекции в глаз (интравитреально).
Перед инъекцией врач тщательно промоет Ваш глаз, для предотвращения инфекции. Кроме того, врач введет местный анестетик с целью облегчения или предупреждения боли, которая может возникнуть в связи с инъекцией.
Продолжительность лечения препаратом Визкью™
Визкью™ применяется для лечения хронических заболеваний глаз, требующих длительного лечения, возможно, в течение нескольких месяцев или лет. Ваш лечащий врач будет проверять эффективность лечения во время регулярных плановых визитов. Ваш врач также может проверять состояние ваших глаз в интервалах между инъекциями. Если у Вас возникают вопросы по продолжительности лечения Визкью™, проконсультируйтесь с врачом.
Прежде чем прекратить лечение Визкью™
Проконсультируйтесь с врачом, прежде чем прекратить лечение. Прекращение лечения может увеличить риск потери или ухудшения зрения.
Если у Вас возникают вопросы по применению данного препарата, проконсультируйтесь с врачом.
Подобно всем лекарственным препаратам, Визкью™ может вызывать нежелательные реакции, однако они возникают не у всех.
Нежелательные реакции, связанные с введением препарата Визкью™, обусловлены самим лекарственным препаратом, либо процедурой его введения и, в основном, затрагивают глаза.
Некоторые нежелательные реакции могут быть серьезными
Немедленно обратитесь за медицинской помощью, если у Вас возникают какие-либо из следующих явлений, которые являются признаками аллергических реакций, воспалений или инфекций:
Если у Вас возникают серьезные нежелательные реакции, немедленно проконсультируйтесь с врачом.
Другие возможные нежелательные реакции
Другие нежелательные реакции, которые могут возникнуть после лечения препаратом Визкью™, перечислены далее.
Большинство нежелательных реакций являются легкими или умеренными и, обычно, исчезают в течение недели после введения препарата.
Если нежелательные реакции становятся серьезными, проконсультируйтесь с врачом.
Часто (могут возникать не более чему 1 пациента из 10):
Нечасто (могут возникать не более чем у 1 пациента из 100):
Сообщение о нежелательных реакциях
Если у Вас возникли какие-либо нежелательные реакции, проконсультируйтесь с врачом или работником аптеки. Данная рекомендация распространяется на любые возможные нежелательные реакции, в том числе и на не перечисленные в данном листке-вкладыше.
Сообщая о нежелательных реакциях, Вы помогаете получить больше сведений о безопасности препарата.
Храните препарат в недоступном для ребенка месте так, чтобы ребенок не мог увидеть его.
Не применяйте препарат после истечения срока годности, указанного на картонной пачке. Датой истечения срока годности является последний день данного месяца.
Хранить в холодильнике (при температуре от 2°С до 8°С).
Не замораживать.
Хранить в оригинальной картонной пачке для защиты от света.
Перед использованием невскрытый флакон можно хранить при комнатной температуре (ниже 25°С) не более 24 часов.
Полное перечисление действующих веществ и вспомогательных веществ препарата Визкью™
Действующее вещество - бролуцизумаб. 1 мл раствора для внутриглазного введения содержит 120 мг бролуцизумаба. Каждый флакон содержит 27,6 мг бролуцизумаба в 0,23 мл раствора, что обеспечивает введение разовой дозы 0,05 мл, содержащей 6 мг бролуцизумаба.
Вспомогательные вещества: сахароза, натрия цитрат, полисорбат 80, гидроксид натрия, вода для инъекций (см. раздел «Особые указания и меры предосторожности»).
Визкью™ представляет собой раствор для внутриглазного введения.
Как выглядит препарат Визкью™
Прозрачный или слегка опалесцирующий, бесцветный или слегка коричневато-желтый водный раствор.
Содержимое упаковки
0,23 мл стерильного раствора для внутриглазного введения в стеклянном флаконе, закрытом резиновой пробкой, обжатой алюминиевым колпачком с отрывной пластиковой накладкой фиолетового цвета.
1 флакон и 1 фильтровальная игла с листком-вкладышем в картонной пачке.
Наименование и адрес держателя регистрационного удостоверения и производителя, ответственного за выпускающий контроль качества
Держатель регистрационного удостоверения:
Novartis Overseas Investments AG, Lichtstrasse 35, 4056 Basel, Switzerland /
Новартис Оверсиз Инвестментс АГ, Лихтштрассе 35, 4056 Базель, Швейцария.
Производитель:
Novartis Pharma Stein AG, Schaffhauserstrasse, 4332 Stein, Switzerland /
Новартис Фарма Штейн АГ, Шаффхаусерштрассе, 4332 Штейн, Швейцария.
За любой информацией о препарате, а также в случаях возникновения претензий следует обращаться к представителю держателя регистрационного удостоверения:
Республика Беларусь:
Представительство АО «Novartis Pharma Services AG» (Швейцарская Конфедерация) в Республике Беларусь;
220069, г. Минск, пр-т Дзержинского, 5, офис 3-1
Тел.: +375173600365
Электронная почта: drugsafety.cis@novartis.com
По рецепту врача.

для внутриглазного введения, Новартис Фарма, Швейцария • По рецепту