Тамовир-Реб, лиофилизат, 500 мг ×1
для приготовления раствора для инфузий, Реб-Фарма, Беларусь • По рецепту
Минск
Каталог
МНН: Ганцикловир
ФТГ: Противовирусное средство
Цены в аптеках: Минск
Лиофилизированный порошок белого цвета.
1 флакон лекарственного средства содержит:
Активное вещество: Ганцикловир (в виде ганцикловира натрия) – 500,00 мг;
Вспомогательные вещества: натрия гидроксид, хлористоводородная кислота.
Противовирусные средства для системного применения. Противовирусные средства прямого действия. Нуклеозиды и нуклеотиды, за исключением ингибиторов обратной транскриптазы.
Код ATX: J05AB06
Фармакодинамика
Механизм действия
Ганцикловир представляет собой синтетический аналог 2'-дезоксигуанозина, который ингибирует репликацию вирусов герпеса как in vitro, так и in vivo. Активен в отношении цитомегаловируса человека (ЦМВ), вирусов простого герпеса 1 и 2 типа (HSV-1 и HSV-2), вируса герпеса человека 6, 7 и 8 типа (HSV-6, HSV-7, HSV-8), вируса Эпштейна-Барра (EBV), вируса ветряной оспы (VZV) и вируса гепатита В.
Клинические исследования ограничивались оценкой эффективности препарата у пациентов, инфицированных ЦМВ.
В ЦМВ-инфицированных клетках ганцикловир первоначально фосфорилируется под действием вирусной протеинкиназы (UL97) до ганцикловирмонофосфата. Дальнейшее фосфорилирование происходит по действием нескольких клеточных киназ, в результате чего образуется ганцикловиртрифосфат, который затем подвергается медленному внутриклеточному метаболизму. Было показано, что этот метоболизм происходит в клетках, инфицированных ЦМВ и вирусом простого герпеса, при этом после исчезновения ганцикловира из внеклеточной жидкости период внутриклеточного полувыведения препарата составляет, соответственно 18 и 6-24 часа. Поскольку фосфорилирование ганцикловира в большей степени зависит от действия вирусной киназы, оно происходит преимущественно в инфицированных вирусом клетках.
Вирусостатическое действие ганцикловира обусловлено подавлением синтеза вирусной ДНК путем: (1) конкурентного ингибирования встраивания дезоксигуанозинтрифосфата в ДНК под действием ДНК-полимеразы; (2) включение ганцикловиртрифосфата в вирусную ДНК, приводящее к прекращению удлинения вирусной ДНК или очень ограниченному ее удлинению. Типичная минимальная концентрация препарата в крови, вызывающая ингибирующий противовирусный эффект в отношении ЦМВ, равный 50 % от максимального (IC50), определенная in vitro, находится в диапозоне от 0,08 мкМ (0,02 мкг/мл) до 14 мкМ (3,57 мкг/мл).
Вирусная резистентность.
Возможность развития вирусной резистентности следует рассматривать у пациентов, у которых неоднократно отмечен неудовлетворительный клинический ответ или имеющих постоянное выделение вируса во время терапии.
Вирусная резистентность к ганцикловиру может возникать за счет ряда мутаций в гене вирусной киназы (UL97), ответственной за монофосфорилирование ганцикловира и / или в гене вирусной полимеразы (UL54). Вирусы, содержащие мутации в гене UL97, устойчивы только к ганцикловиру, тогда как вирусы с мутациями в гене UL54 устойчивы к ганцикловиру, но могут вызывать перекрестную резистентность к другим противовирусным препаратам, воздействующим на вирусную полимеразу.
Детский возраст
В проспективном исследовании 36 детей с тяжелым нарушением иммунитета (в возрасте от 6 месяцев до 16 лет) с ВИЧ и ЦМВ инфекцией получали ганцикловир внутривенно в дозе 5 мг/кг в сутки в течение 2 дней с последующим пероральным применением ганцикловира в течение среднего периода времени в 32 недели. Ганцикловир являлся эффективным, а его профиль токсичности был аналогичен профилю у взрослых. Ганцикловир вызывал снижение обнаружения ЦМВ культуральным методом или методом полимеразной цепной реакции. Нейтропения являлась единственной тяжелой нежелательной лекарственной реакцией, наблюдавшейся во время исследования, и хотя ни одному из детей не требовалось прекращение терапии, четверым детям потребовалось применение гранулоцитарного колониестимулирующего фактора (Г-КСФ) для поддержания абсолютного количества нейтрофилов > 400 клеток/мм3.
В ретроспективном исследовании 122 ребенка-реципиента трансплантированной печени (в возрасте от 16 дней до 18 лет, медиана возраста 2,5 года) не менее 14 дней получали ганцикловир внутривенно в дозе 5 мг/кг два раза в сутки с последующим превентивным ПЦР-мониторингом ЦМВ. Риск развития ЦМВ у сорока трех пациентов считался высоким и у 79 пациентов - обычным. Бессимптомная ЦМВ инфекция была выявлена ПЦР- методом у 34,4% субъектов и являлась более вероятной у реципиентов с высоким риском, чем с обычным риском (58,1% и 21,8%, р = 0,0001). У двенадцати субъектов (9,8%) развилось ЦМВ заболевание (8 пациентов с высоким риском и 4 пациента с обычным риском, р = 0,03). У трех субъектов наблюдалось острое отторжение в течение 6 месяцев после выявления ЦМВ, но у 13 пациентов отторжение предшествовало инфекции ЦМВ. Случаев смерти вследствие ЦМВ инфекции не наблюдалось. У 38,5% субъектов применялось меньшее количество противовирусных препаратов, использовавшихся помимо первоначальной послеоперационной профилактики.
В ретроспективном анализе сравнивались безопасность и эффективность ганцикловира и валганцикловира у 92 детей-реципиентов почек и/или печени (возраст от 7 месяцев до 18 лет, медиана возраста 9 лет). Все дети получали ганцикловир внутривенно в дозе 5 мг/кг два раза в сутки в течение 2 недель после трансплантации. Дети, подвергавшиеся лечению до 2004 г., затем получали ганцикловир перорально в дозировке от 30 мг/кг/доза до 1 г/доза три раза в сутки (n = 41), в то время как дети, подвергавшиеся лечению после 2004 г., получали валганцикловир в дозировке до 900 мг 1 раз в сутки (n = 51). Общая частота возникновения ЦМВ составляла 16% (15/92 пациентов). Время до начала ЦМВ инфекции являлось сходным в двух группах.
В рандомизированном контролируемом исследовании 100 новорожденных (в возрасте ≤1 месяц) с симптоматическим врожденным ЦМВ заболеванием с влиянием на ЦНС получали ганцикловир внутривенно в течение 6 недель в дозировке 6 мг/кг каждые 12 часов или не подвергались лечению. Из 100 включенных пациентов 42 соответствовали всем критериям исследования и проходили аудиометрическую оценку в исходный момент и после 6-месячного периода наблюдения. 25 из них получали ганцикловир и 17 не подвергались лечению. 21 из 25 пациентов, получавших ганцикловир, продемонстрировали улучшение слуха или сохранение нормального слуха в период с исходного момента до 6 месяцев, по сравнению с 10/17 контрольных пациентов (84% и 59%, соответственно, р = 0,06). Ни у одного из пациентов, получавших ганцикловир, не отмечалось ухудшения слуха в период с исходного момента до 6 месяцев, по сравнению с 7 контрольными пациентами (р < 0,01). К окончанию первого года с исходного момента времени 5/24 пациентов, получавших ганцикловир, и 13/19 контрольных пациентов имели ухудшение слуха (р < 0,01). Во время исследования 29/46 пациентов, получавших ганцикловир, имели нейтропению, по сравнению с 9/43 контрольных пациентов (р < 0,1). Было отмечено 9 случаев смерти в периоде исследования: 3 случая в группе лечения ганцикловиром и 6 в контрольной группе. Ни один из случаев смерти не был связан с исследуемым препаратом.
В рандомизированном контролируемом исследовании III фазы 100 новорожденных (возраст 3-33 дня, медиана возраста 12 дней) с тяжелым симптоматическим врожденным ЦМВ заболеванием с влиянием на ЦНС получали ганцикловир внутривенно в течение 6 недель в дозировке 6 мг/кг 2 раза в сутки (n = 48) или не получали противовирусного лечения (n = 52). Младенцы, получавшие ганцикловир, демонстрировали улучшение развития нервной системы через 6 и 12 месяцев, по сравнению с теми, кто не получал противовирусного лечения. Хотя пациенты, получавшие ганцикловир, имели меньше задержек и больше нормальных неврологических исходов, большинство из них все еще не соответствовали нормальному развитию в возрасте 6 недель, 6 месяцев или 12 месяцев. Безопасность в данном исследовании не оценивалась.
Ретроспективное исследование изучало эффект противовирусного лечения в отношении потери слуха с поздним началом у младенцев с врожденной ЦМВ инфекцией (возраст 4- 34 месяца, средний возраст 10,3 ± 7,8 месяца, медиана возраста 8 месяцев). Исследование включало 21 младенца с нормальным слухом при рождении, у которых возникла потеря слуха с поздним началом. Противовирусное лечение представляло собой:
Ни одному из детей не требовалась установка кохлеарного импланта, и потеря слуха улучшалась в 83% ушей, пораженных потерей слуха в исходный момент. Нейтропения являлась единственным сообщавшимся побочным эффектом, и ни одному пациенту не требовалось отмены лечения.
Фармакокинетика
Фармакокинетические характеристики ганцикловира оценивались у ВИЧ- и ЦМВ- сероположительных пациентов, пациентов со СПИДом и ЦМВ-ретинитом, а также у пациентов, перенесших трансплантацию печени.
Распределение
Объем распределения ганцикловира после в/в введения коррелирует с массой тела и в равновесной концентрации составляет 0,54-0,87 л / кг. Связывание с белками плазмы составляет - 1% -2% при концентрации ганцикловира от 0,5 до 51 мкг / мл. Ганцикловир проникает в спинномозговую жидкость, где наблюдаемые концентрации составляют 24-67% от концентрации в плазме.
Метаболизм
Значимого метаболизма ганцикловира не происходит.
Выведение
Основной путь выведения ганцикловира - почечная экскреция неизменного препарата путем клубочковой фильтрации и активной канальцевой секреции. У пациентов с нормальной функцией почек более 90% от внутривенно введенной дозы ганцикловира обнаруживается в моче в неизменном виде в течение 24 часов. У пациентов с нормальной функцией почек системный клиренс находится в диапазоне от 2,64 ± 0,38 мл / мин / кг (N = 15) до 4,52 ± 2,79 мл / мин / кг (N = 6), а почечный клиренс варьировался от 2,57 ± 0,69 мл / мин / кг (N = 15) до 3,48 ± 0,68 мл / мин / кг (N = 20), что соответствует 90% -101% введенного ганцикловира. Период полувыведения у пациентов с нормальной функцией почек колеблется от 2,73 ± 1,29 (N = 6) до 3,98 ± 1,78 часа (N = 8).
Линейностъ/нелинейностъ
При внутривенном введении в диапазоне концентраций 1,6-5,0 мг / кг фармакокинетика ганцикловира имеет линейный характер.
Отдельные группы пациентов
Пациенты с почечной недостаточностью
Общий клиренс ганцикловира линейно коррелирует с клиренсом креатинина. У пациентов с легким, умеренным и тяжелым нарушением функции почек отмечался средний системный клиренс 2,1, 1,0 и 0,3 мл / мин / кг. У пациентов с нарушением функции почек увеличивается период полувыведения и, в зависимости от функции почек, он составляет от 6 до 17 часов.
| Креатинин сыворотки крови (мкмоль/л) | Клиренс креатинина (мл/мин) | Средний плазматический клиренс ганцикловира (мл/мин) | Средний период полувыведения ганцикловира из плазмы (часы) |
| < 125 | ≥70 | 208 | 3,0 |
| 125-175 | 50-69 | 102 | 4,8 |
| 176-350 | 25-49 | 87 | 5,5 |
| >350 | 10-24 | 34 | 11,5 |
Концентрация ганцикловира в плазме после внутривенного введения снижается примерно на 50% в течение 4-часового сеанса гемодиализа.
При использовании прерывистой схемы гемодиализа показатели клиренса ганцикловира составляют от 42 до 92 мл / мин, период полувыведения препарата во время диализа 3,3- 4,5 часа. При прерывистом гемодиализе фракция ганцикловира, удаленного за один сеанс гемодиализа, составляет от 50 % до 63 %. При непрерывном диализе клиренс ганцикловира был ниже (4,0-29,6 мл / мин), но в период до следующего приема препарата из организма удалялся больший процент принятой дозы.
Детский возраст
Фармакокинетика ганцикловира при внутривенном введении в дозе 200 мг/м2 была изучена в двух исследованиях, включавших детей в возрасте от 3 месяцев до 16 лет, перенесших трансплантацию печени (n=18) или почек (n=25). Фармакокинетика ганцикловира также была оценена при помощи популяционной фармакокинетической модели. Клиренс креатинина оказывал статистически значимое влияние на клиренс ганцикловира, а рост пациента - на клиренс ганцикловира, объем распределения при достижении равновесной концентрации и периферический объем распределения. Включение в модель клиренса креатинина и роста пациента позволило объяснить все возрастные различия в фармакокинетике ганцикловира, при этом ни возраст, ни пол, ни тип трансплантата не оказывали статистически значимого влияния на фармакокинетические параметры ганцикловира в изучаемых популяциях.
Фармакокинетические параметры ганцикловира при внутривенном введении в дозе 200 мг/м2 пациентам, перенесшим трансплантацию печени или почек*
| < 6 лет | 6 - <12 лет | >12 - <16 лет | |
| n=17 | n=9 | n=17 | |
| Клиренс (л/ч) | 4,23 (2,11-7,92) | 4,03 (1,88-7,8) | 7,53 (2,89-16,8) |
| Vцентр, (л) | 1,83 (0,45-5,05) | 6,48 (3,34-9,95) | 12,1 (3,6-18,4) |
| Vпериф- (л) | 5,81 (2,9-11,5) | 16,4(11,3-20,1) | 27(10,6-39,3) |
| Vss (л) | 8,06 (3,35-16,6) | 22,1 (14,6-30,1) | 37,9(16,5-57,2) |
| AUC 0-74ч (мкг xч/мл) | 24,3 (14,1-38,9) | 40,4(17,7-48,6) | 37,6 (19,2-80,2) |
| Cмах (мкг/мл) | 12,1 (9,17-15) | 13,3 (4,73-15) | 12,4(4,57-30,8) |
Фармакокинетика ганцикловира при внутривенном введении по схеме, рекомендованной для взрослых пациентов (5 мг/кг внутривенно в течение 1 ч) была изучена на небольшой группе детей с нормальной функцией почек в возрасте от 9 месяцев до 12 лет (n=10, медиана возраста 3,1 года). Значения AUC о-∞ на 1-е сутки (n=10) и AUC 0-12 на 14- е сутки (n =7) составили 19,4±7,1 мкгхч/мл и 24,1± 14,6 мкгхч/мл, соответствующие значения Смах были равны 7,59±3,21 мкг/мл (1-е сутки) и 8,31±4,9 мкг/мл (14-е сутки). В этом исследовании при расчете дозы на основании массы тела у детей младшего возраста наблюдались более низкая экспозиция. У детей в возрасте до 5 лет средние значения AUC о-оо на 1-е сутки (n=7) и АИСо-12 на 14-е сутки (n=4) составили 17,7±5,5 мкгхч/мл и 17,1 ±7,5 мкгхч/мл.
При внутривенном введении ганцикловира в дозах, рассчитанных на основании площади поверхности тела и функции почек (ЗхППТхКК), экспозиция у детей в возрасте от рождения до 16 лет была схожей (см. таблицу).
AUC о-24ч ганцикловира (мкгхч/мл) у детей при введении путем внутривенной инфузии в течение 1 ч в дозе (мг), рассчитанной по формуле (3 хППТхКК)*
| <4 мес. | >4 мес.- <2 лет | >2-<6 лет | >6 - <12 лет | >12-<16 лет | Все пациенты | |
| Количество пациентов | 781 | 384 | 86 | 96 | 126 | 1473 |
| Медиана | 55,6 | 56,9 | 54,4 | 51,3 | 51,4 | 55,4 |
| Среднее значение | 57,1 | 58,0 | 55,1 | 52,6 | 51,8 | 56,4 |
| Минимум | 24,9 | 24,3 | 16,5 | 23,9 | 22,6 | 16,5 |
| Макимум | 124,1 | 133,0 | 105,7 | 115,2 | 94,1 | 133,0 |
| Пациенты с AUC<40 мкг*ч/мл |
89
(11 %) |
38 (10%) |
13
(15 %>) |
23
(24 %) |
28 (22 %) | 191 (13%) |
| Пациенты с AUC 40- 60 мкг*ч/мл | 398 (51 %) |
195
(51 %) |
44
(51 %) |
41
(43 %) |
63
(50 %) |
741
(50 %) |
| Пациенты с AUC>60 мкг*ч/мл | 294 (38%) |
151
(39 %) |
29 (34%) | 32 (33 %) | 35 (28%) |
541
(37 %) |
Пациенты пожилого возраста
Изучение фармакокинетики ганцикловира у лиц старше 65 лет не проводилось.
Взрослые и дети старше 12 лет:
Дети до 12 лет:
Следует учитывать официальные руководства по надлежащему применению противовирусных средств.
Лечение ЦМВ инфекции
Взрослые и дети ≥12 лет с нормальной функцией почек:
Дети до 12 лет
Имеющиеся данные о применении ганцикловира у детей младше 12 лет приведены в разделах «Фармакодинамические свойства» и «Фармакокинетические свойства», однако рекомендации по дозированию препарата на сегодняшний день не разработаны.
Превентивная терапия ЦМВ инфекции
Взрослые и дети >12 лет с нормальной функцией почек:
Дети до 12 лет
Имеющиеся данные о применении ганцикловира у детей младше 12 лет приведены в разделах «Фармакодинамические свойства» и «Фармакокинетические свойства», однако рекомендации по дозированию препарата на сегодняшний день не разработаны.
Профилактика ЦМВ инфекции с использованием универсальной терапии
Взрослые и дети ≥16 лет: внутривенная инфузия 5 мг / кг через 1 раз в сутки на протяжении 7 дней или 6 мг / кг 1 раз в сутки на протяжении 5 дней. Продолжительность терапии основана на оценке риска развития ЦМВ инфекции и должна определяться индивидуально для каждого пациента.
Дети младше 16 лет:
Тамовир-Реб вводят внутривенно в течение 1 часа одни раз в сутки. Рекомендуемую суточную дозу препарата рассчитывают на основании площади поверхности тела (ППТ) и клиренса креатинина (КК), по приведенным ниже формулам. Продолжительность универсальной терапии основана на оценке риска развития ЦМВ инфекции и должна определяться индивидуально для каждого пациента.

k=0.33 для пациентов <1 года с низкой массой тела при рождении;
k=0,45 для пациентов <2 лет;
k=0,55 для мальчиков от 2 до 12 лет и девочек от 2 до 16 лет;
k=0,7 для мальчиков от 13 до 16 лет. Для пациентов старше 16 лет см. дозировку для взрослых.
Представленные значения k применяются при определении уровня сывороточного креатинина по методу Яффе. В случае использования ферментативных методов определения уровня креатинина могут потребоваться корректировки.
Если расчетный клиренс креатинина превышает 150 мл/мин/1,73 м2, то в дальнейших расчетах следует использовать максимальное значение 150 мл/мин/1,73 м2. Рекомендуется регулярно пересматривать и корректировать дозу по мере необходимости в зависимости от уровня сывороточного креатинина, веса и роста.
Особые указания по дозированию
Пациенты с почечной недостаточностью
Дети (с рождения до 16 лет) с почечной недостаточностью, получающие профилактическую дозу ганцикловира, рассчитанную с использованием алгоритма дозирования 3 х ППТ х КК, не требуют дополнительной корректировки дозы.
Взрослые и дети старше 12 лет с почечной недостаточностью, которые проходят лечение ЦМВ инфекции превентивной терапией на основе массы тела (мг / кг), дозу ганцикловира в мг / кг следует корректировать в соответствии с клиренсом креатинина, как показано таблице ниже.
Коррекция дозы для пациентов с почечной недостаточностью
| Клиренс креатинина (КК) | Начальная доза | Поддерживающая доза |
| >70 мл/мин | 5.0 мг/кг каждые 12 часов | 5.0 мг/кг/сутки |
| 50-69 мл/мин | 2.5 мг/кг каждые 12 часов | 2.5 мг/кг/сутки |
| 25-49 мл/мин | 2.5 мг/кг/сутки | 1.25 мг/кг/сутки |
| 10-24 мл/мин | 1.25 мг/кг/сутки | 0.625 мг/кг/сутки |
| <10 мл/мин | 1.25 мг/кг 3 раза в неделю после гемодиализа | 0.625 мг/кг 3 раза в неделю после гемодиализа |
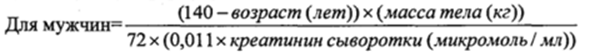
Для женщин = 0,85*показатель для мужчин
Поскольку у пациентов с почечной недостаточностью дозу ганцикловира следует корректировать, необходимо тщательно контролировать уровень креатинина сыворотки или расчетный клиренс креатинина.
Пациенты с печеночной недостаточностью
Эффективность и безопасность применения ганцикловира у пациентов с печеночной недостаточностью не изучалась.
Пациенты с тяжелой формой лейкопении, нейтропении, анемии, тромбоцитопении и панцитопении
Если во время терапии ганцикловиром наблюдается значительное снижение количества клеток крови, рекомендуется проводить лечение гемопоэтическими ростовыми факторами и/или отменить терапию.
Пожилые пациенты
Испытаний эффективности и безопасности ганцикловира на пожилых пациентах не проводилось. Поскольку у лиц старческого возраста функция почек нередко снижена, ганцикловир следует назначать строго с учетом функции почек.
Способ применения
Перед применением необходимо приготовить раствор препарата в соответствии с инструкцией, приведенной в разделе «Особые меры предосторожности при работе с лекарственным препаратом».
Тамовир-Реб применяется только для внутривенного введения, предпочтительно через пластиковую канюлю, в вену с хорошим кровотоком.
Тамовир-Реб следует вводить путем внутривенной инфузии в течение 1 часа при концентрации не более 10 мг/мл. Препарат не следует вводить быстро или струйно, поскольку избыточные концентрации ганцикловира в плазме могут усилить его токсичность.
Внутримышечное или подкожное введение может вызвать сильное раздражение тканей из-за высокого рН~11 раствора ганцикловира.
Не следует превышать рекомендуемую дозировку, частоту или скорость инфузии препарата.
Меры предосторожности, которые необходимо соблюдать перед применением препарата или при работе с ним:
Поскольку ганцикловир считается потенциальным тератогеном и канцерогеном у человека, необходимо соблюдать осторожность при обращении с ним.
Приготовление восстановленного концентрата
Приготовление восстановленного концентрата Тамовир-Реб следует осуществлять в асептических условиях.
Приготовленный раствор во флаконе при комнатной температуре устойчив в течение 12 часов. Не охлаждать. Не замораживать.
С микробиологической точки зрения восстановленный раствор следует использовать немедленно. Если препарат не использован незамедлительно, то срок и условия хранения приготовленного раствора перед применением являются ответственностью пользователя.
Приготовление конечного разведенного раствора для инфузий
Из флакона с приготовленным раствором препарата (концентрация ганцикловира 50 мг/мл) набирают рассчитанную (с учетом массы тела пациента и показаний) дозу препарата и добавляют в базовый инфузионный раствор (0,9 % раствор натрия хлорида, 5 % водный раствор декстрозы, раствор Рингера или Рингер-лактата).
Поскольку Тамовир-Реб разводится небактериостатической стерильной водой, для уменьшения риска бактериального заражения инфузионный раствор должен быть использован немедленно, в ином случае инфузионный раствор химически и физически стабилен в течение 24 часов после приготовления. Инфузионный раствор хранят в холодильнике. Не рекомендуется замораживать раствор. Если препарат не использован незамедлительно, то срок и условия хранения приготовленного раствора перед применением являются ответственностью пользователя и не должен превышать 24 часа при 2-8 °C, при условии, что разведение произведено в контролируемых и валидированных асептических условиях.
Вводить в концентрации более 10 мг/мл ганцикловира не рекомендуется, Тамовир-Реб нельзя смешивать с другими внутривенно вводимыми препаратами.
Разведенный раствор вводят внутривенно путем инфузии в течение 1 часа. Не следует применять препарат путем внутримышечной или подкожной инъекции, так как это может приводить к сильному раздражению из-за высокого значения pH (⁓11) раствора ганцикловира.
У пациентов, получавших терапию ганцикловиром, наиболее серьезными и частыми нежелательными реакциями являются гематологические нарушения, а именно нейтропения, анемия и тромбоцитопения. Другие нежелательные реакции представлены ниже.
| Инфекционные и паразитарные заболевания: | |
| Часто (≥ 1/100, < 1/10) | Сепсис, целлюлит, инфекция мочевыводящих путей, кандидозные инфекции, включая кандидоз ротовой полости |
| Нарушения со стороны крови и лимфатической системы: | |
| Очень часто (≥ 1/10): | Нейтропения, анемия |
| Часто (≥ 1/100, < 1/10) | Тромбоцитопения, лейкопения, панцитопения |
| Нечасто (≥ 1/1000, < 1/100) | Недостаточность костного мозга |
| Редко (≥ 1/10000, < 1/1000) | Агранулоцитоз*, апластическая анемия*, гранулоцитопения* |
| Нарушения со стороны иммунной системы: | |
| Нечасто (≥ 1/1000, < 1/100) | Анафилактическая реакция |
| Нарушения со стороны обмена веществ и питания: | |
| Часто (≥ 1/100, < 1/10) | Снижение аппетита, анорексия, снижение массы тела |
| Нарушения психики: | |
| Часто (≥ 1/100, < 1/10) | Депрессия, тревога, спутанность сознания, патологическое мышление |
| Нечасто (≥ 1/1000, <1/100) | Возбуждение, психотическое расстройство |
| Редко (≥ 1/10000, < 1/1000) | Галлюцинации* |
| Нарушения со стороны нервной системы: | |
| Часто (≥ 1/100, < 1/10) | Головная боль, бессонница, дисгевзия, гипестезия, парестезия, периферическая невропатия, судороги, головокружение |
| Нечасто (≥ 1/1000, < 1/100) | Тремор |
| Нарушения со стороны органа зрения: | |
| Часто (≥ 1/100, <1/10) | Макулярный отек, отслоение сетчатки, плавающие помутнения в стекловидном теле, боль в глазах |
| Нечасто (≥ 1/1000, < 1/100) | Нарушение зрения, конъюнктивит |
| Нарушения со стороны органа слуха и равновесия : | |
| Часто (≥ 1/100, < 1/10) | Боль в ушах |
| Нечасто (≥ 1/1000, < 1/100) | Глухота |
| Нарушения со стороны сердца: | |
| Нечасто≥ 1/1000, < 1/100) | Сердечные аритмии |
| Нарушения со стороны сосудов: | |
| Нечасто (≥ 1/1000, < 1/100) | Гипотензия |
| Нарушения со стороны органов дыхания, грудной клетки и средостения: | |
| Очень часто (≥ 1/10) | Одышка |
| Часто (≥ 1/100, < 1/10) | Кашель |
| Нарушения со стороны желудочно-кишечного тракта: | |
| Очень часто (≥ 1/10) | Диарея |
| Часто (≥1/100, < 1/10) | Тошнота, рвота, боль в животе, боль в верхней части живота, запор, метеоризм, дисфагия, диспепсия |
| Нечасто (≥ 1/1000, <1/100) | Вздутие живота, изъязвление полости рта, панкреатит |
| Нарушения со стороны печени и желчевыводящих путей: | |
| Часто (≥ 1/100, < 1/10) | Аномальная функция печени, повышение уровней щелочной фосфатазы в крови, повышение уровней аспартатаминотрансферазы |
| Нечасто (≥ 1/1000, < 1/100) | Повышение уровней аланинаминотрансферазы |
| Нарушения со стороны кожи и подкожной клетчатки: | |
| Часто (≥ 1/100, < 1/10) | Дерматит, ночная потливость, зуд |
| Нечасто (≥1/1000, <1/100) | Алопеция, крапивница, сухость кожи |
| Редко (≥ 1/10000, < 1/1000) | Сыпь* |
| Нарушения со стороны скелетно-мышечной и соединительной ткани: | |
| Часто (≥ 1/100, < 1/10) | Боль в спине, миалгия, артралгия, мышечные спазмы |
| Нарушения со стороны почек и мочевыводящих путей: | |
| Часто (≥ 1/100, < 1/10) | Снижение почечного клиренса креатинина, нарушение функции почек, повышение уровня креатинина в крови |
| Нечасто (> 1/1000, < 1/100) | Гематурия, почечная недостаточность |
| Нарушения со стороны репродуктивной системы и молочной железы: | |
| Нечасто (≥ 1/1000, < 1/100) | Мужское бесплодие |
| Общие расстройства и нарушения в месте введения: | |
| Часто (≥ 1/100, < 1/10) | Утомление, жар, озноб, боль, боль в грудной клетке, недомогание, астения, реакция в месте инъекции |
Пролекарством ганцикловира является валганцикловир, соответственно при приеме ганцикловира можно ожидать тех же побочных реакций, что и при применении валганцикло- вира. Нежелательные реакции, ранее отмечавшиеся при применении ганцикловира внутрь (ганцикловир для перорального приема более не доступен), могут так же наблюдаться у пациентов, получавших ганцикловир внутривенно. Таким образом, в список нежелательных реакций включены реакции, отмечавшиеся при в/в введении или пероральном приеме ганцикловира, а также при применении валганцикловира.
Описание отдельных нежелательных реакций
Нейтропения
Риск развития нейтропении нельзя предсказать, исходя из числа нейтрофилов до начала лечения. Как правило, нейтропения возникает в течение первой или второй недели начальной терапии и после введения кумулятивной дозы ≤200 мг/кг. Число клеток обычно нормализуется в течение 2-5 дней после прекращения применения препарата или снижения дозы.
Тромбоцитопения
У пациентов с низким исходным уровнем тромбоцитов (<100000/мкл) повышен риск развития тромбоцитопении. У пациентов с ятрогенной иммуносупрессией, обусловленной применением иммунодепрессантов, риск развития тромбоцитопении выше, чем у пациентов со СПИДом. Тяжелая тромбоцитопения может сопровождаться потенциально жизнеугрожающими кровотечениями.
Судороги
У пациентов, получавших имипенем/циластатин и ганцикловир, отмечались случаи судорог.
Отслойка сетчатки
Эта нежелательная реакция наблюдалась только в клинических исследованиях у пациентов со СПИДом, получавших лечение ганцикловиром по поводу ЦМВ ретинита.
Реакции в месте инъекции
Реакции в месте инъекции часто наблюдаются у пациентов, получающих ганцикловир. Тамовир-Реб следует вводить в соответствии с рекомендациями, представленными в инструкции, для снижения риска возникновения местного раздражения тканей.
Дети
Официальные исследования безопасности ганцикловира у детей младше 12 лет не проводились, но на основании опыта применения валганцикловира (пролекарства ганцикловира) общий профиль безопасности активного вещества схож у детей и взрослых. Однако частота возникновения некоторых неблагоприятных реакций, таких как жар и боль в животе, которые могут быть характерными для пациентов детского возраста, является более высокой у детей, чем у взрослых. Нейтропения также возникает у детей чаще, но частота развития нейтропении у детей не влияет на частоту инфекционных осложнений.
Имеются ограниченные данные о применении ганцикловира или валганцикловира у новорожденных и детей младше двух лет с ВИЧ/СПИДом или симптоматической врожденной ЦМВ инфекцией, однако профиль безопасности соответствует известному профилю безопасности валганцикловира/ганцикловира.
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза-риск» лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальную систему сообщения о нежелательных реакциях (УП «Центр экспертиз и испытаний в здравоохранении», https://www.rceth.bv).
Перекрестная гиперчувствительность
Вследствие сходства химической структуры ганцикловира, ацикловира и пенцикловира возможно развитие реакции перекрестной гиперчувствительности между этими препаратами. Следует соблюдать осторожность при назначении препарата Тамовир-Реб пациентам с известной гиперчувствительностью к ацикловиру или пенцикловиру (или к их пролекарствам валацикловиру или фамцикловиру, соответственно).
Мутагенность, тератогенность, канцерогенность, фертильность и контрацепция
Перед началом лечения ганцикловиром пациентов следует проинформировать о возможных рисках для плода. В исследованиях на животных ганцикловир оказывал мутагенное, тератогенное, асперматогенное и канцерогенное действие, а также нарушал фертильность. Ганцикловир может вызывать временное или постоянное ингибирование сперматогенеза. Таким образом, ганцикловир обладает потенциальным тератогенным и канцерогенным действием у человека, может вызывать врожденные пороки развития и злокачественные новообразования. Женщинам детородного возраста следует рекомендовать использование эффективных методов контрацепции во время лечения ганцикловиром и в течение не менее чем 30 дней после его окончания. Мужчинам следует рекомендовать использование барьерного метода контрацепции во время лечения ганцикловиром и не менее чем 90 дней после его окончания, за исключением случаев отсутствия риска беременности партнерши. При применении ганцикловира необходимо соблюдать предельную осторожность, особенно в педиатрии, из-за возможности развития отдаленной канцерогенности и токсичности в отношении репродуктивной системы. Польза от лечения должна быть тщательно рассмотрена в каждом конкретном случае и должна однозначно превосходить риск.
Миелосупрессия
Тамовир-Реб следует применять с осторожностью у пациентов с существующей гематологической цитопенией или указаниями на гематологическую цитопению, вызванную лекарственными средствами, в анамнезе, а также у пациентов, получающих лучевую терапию.
У пациентов, принимавших ганцикловир, наблюдались случаи тяжелой лейкопении, нейтропении, анемии, тромбоцитопении, панцитопении и недостаточности костного мозга. Лечение не следует начинать, если абсолютное число нейтрофилов составляет менее 500 клеток/мкл или число тромбоцитов составляет менее ?5000 клеток/мклгжшеслиуро- вень гемоглобина составляет менее 8 г/дл.
Рекомендуется контролировать число форменных элементов крови, включая число тромбоцитов, во время лечения. У пациентов с нарушением функции почек необходимо проводить усиленный гематологический мониторинг. В первые 14 дней применения рекомендуется контролировать число лейкоцитов через день (предпочтительно проведение дифференциального теста); у пациентов с низким исходным уровнем нейтрофилов (<1000 нейтрофилов/мкл), у пациентов с развившейся лейкопенией во время предшествующей терапии другими миелотоксичными средствами и у пациентов с нарушением функции почек мониторинг следует проводить ежедневно.
У пациентов с тяжелой лейкопенией, нейтропенией, анемией и/или тромбоцитопенией рекомендуется проводить лечение гемопоэтическими факторами роста и/или временно прервать терапию ганцикловиром.
Нарушение функции почек
У пациентов с нарушением функции почек повышается риск развития токсичности (в особенности гематологической токсичности). Требуется снижение дозы (см. Способ применения и дозировка и Фармакокинетика).
У пациентов, принимавших имипенем/циластатин и ганцикловир, описано развитие судорог. Не следует применять ганцикловир одновременно с имипенемом/циластатином, если только потенциальные преимущества терапии не превышают возможного риска.
Пациенты, принимающие ганцикловир и диданозин - препараты, известные как миелосу- прессивные или негативно влияющие на функцию почек - должны подвергаться тщательному контролю на наличие признаков дополнительной токсичности.
Лекарственный препарат содержит 2 ммоль (43 мг) натрия на дозу в 500 мг. Это следует принимать во внимание у пациентов, соблюдающих диету с контролем количества натрия.
Фармакокинетические взаимодействия
Пробенецид. Пробенецид конкурирует с ганцикловиром за канальцевую секрецию, в результате чего, при одновременном приеме данных препаратов наблюдалось уменьшение почечного клиренса ганцикловира. Следует тщательно наблюдать за состоянием пациентов, принимающих пробенецид и ганцикловир, из-за возможного появления симптомов токсичности последнего.
Диданозин. При одновременном применении диданозина и внутривенном введении ганцикловира концентрации диданозина в плазме повышаются. При внутривенном введении ганцикловира в дозах 5 - 10 мг / кг в сутки AUC диданозина увеличевалась на 38-67 %. Изменения концентраций ганцикловира при этом не было клинически значимым. Однако, с учетом повышения плазменных концентраций диданозина в присутствии ганцикловира, пациентов следует внимательно наблюдать на предмет токсичности диданозина.
Микофенолата мофетил, ставудин, триметоприл и зидовудин. Значимого фармакокинетического взаимодействия при применении ганцикловира в комбинации с микофенолата мофетилом, ставудином, триметопримом или зидовудином не наблюдалось.
Другие антиретровирусные препараты. Изоферменты цитохрома Р450 не играют роли в фармакокинетике ганцикловира. Вследствие этого не ожидается фармакокинетических взаимодействий с ингибиторами протеазы и ненуклеозидными ингибиторами обратной транскриптазы.
Фармакодинамические взаимодействия
Имипенем - циластатин
У пациентов, одновременно принимавших ганцикловир и имипенем/циластатин, описано развитие судорог. Не следует применять эти препараты одновременно, если только потенциальные преимущества терапии не превышают возможного риска.
Другие потенциальные лекарственные взаимодействия
Возможно усиление токсичности при применении ганцикловира одновременно с другими препаратами, обладающими миелосупрессивным действием или нарушающими функцию почек (такими как дапсон, пентамидин, флуцитозин, винкристин, винбластин, доксорубицин, амфотерицин В, микофенолата мофетил, триметоприм/сульфаметоксазол, гидроксимочевина), а также аналогами нуклеозидов (включая зидовудин). Таким образом, эти препараты следует назначать одновременно с ганцикловиром только в том случае, если потенциальные преимущества превышают возможный риск.
Дети
Исследования взаимодействия проводились только у взрослых.
Фертильность
В исследованиях на животных ганцикловир нарушал фертильность у самцов и самок мышей. На основании возникновения асперматогенеза при экспозициях ганцикловира ниже терапевтических уровней в исследованиях на животных считается вероятным временное или постоянное ингибирование ганцикловиром сперматогенеза у человека.
Беременность
Безопасность ганцикловира при применении у беременных женщин не установлена. Известно, что ганцикловир хорошо проникает через плаценту у человека. В исследованиях на животных ганцикловир проявлял репродуктивную токсичность и тератогенность. По этой причине ганцикловир следует применять у беременных женщин только в тех случаях, когда клиническая необходимость в лечении для женщины превышает потенциальный риск тератогенности для плода.
Контрацепция у мужчин и женщин
Вследствие потенциальной репродуктивной токсичности и тератогенности ганцикловира женщинам детородного возраста следует рекомендовать использование эффективных методов контрацепции во время лечения и в течение не менее чем 30 дней после его окончания. Пациентам мужского пола следует рекомендовать использование барьерного метода контрацепции во время лечения ганцикловиром и не менее чем 90 дней после его окончания, за исключением случаев отсутствия риска беременности у партнерши.
Грудное вскармливание
Не установлено, проникает ли ганцикловир в грудное молоко, однако нельзя исключить, что ганцикловир будет выводиться с молоком и вызывать тяжелые нежелательные реакции у грудного ребенка. Таким образом, при применении ганцикловира грудное вскармливание следует прекратить.
Тамовир-Реб может оказывать сильное влияние на способность к вождению автотранспорта и управлению механизмами.
Случаи передозировки отмечались при внутривенном введении ганцикловира, в том числе с летальным исходом, как в клинических исследованиях, так и при пострегистарционном применении препарата. В большинстве сообщений передозировка не сопровождалась возникновением нежелательных реакций или сопровождалась одной или несколькими нежелательными реакциями, указанными ниже.
Лечение
Ганцикловир выводится из организма при гемодиализе, поэтому гемодиализ может быть целесообразным для снижения экспозиции лекарственного препарата у пациентов с передозировкой ганцикловира.
Дополнительная информация об особых группах
Пациенты с нарушением функции почек: у пациентов с нарушением функции почек передозировка ганцикловира может сопровождаться более выраженной нефротоксичностью.
Дети
Дополнительные сведения отсутствуют.
Хранить при температуре не выше 25°С. Хранить в недоступном для детей месте!
Срок годности 3 года. Не использовать по истечении срока годности, указанного на упаковке.
Утилизация
Особые меры предосторожности при работе с лекарственным препаратом, при утилизации использованного лекарственного средства или отходов, полученных после применения лекарственного средства
Поскольку Тамовир-Реб считается потенциальным тератогеном и канцерогеном, необходимо соблюдать осторожность при обращении с ним. Необходимо избегать вдыхания или прямого контакта порошка, содержащегося во флаконах, или прямого контакта восстановленного раствора с кожей или слизистыми оболочками. Растворы препарата Тамовир- Реб являются щелочными (pH ⁓11). В случае такого контакта необходимо тщательно промыть место контакта водой с мылом, промыть глаза чистой водой.
Препарат предназначен только для однократного применения. Неиспользованный препарат или отходы утилизируют в соответствии установленными национальным законодательством требованиями.
По рецепту врача.
По 500 мг во флаконы из бесцветного стекла, укупоренные пробками из бромбутилкаучу- ка, обкатанные комбинированными алюминиевыми колпачками «флип-офф» с пластиковыми крышками.
1 флакон вместе с листком-вкладышем помещают в пачку картонную.
Информация о производителе
для приготовления раствора для инфузий, Реб-Фарма, Беларусь • По рецепту