
Клайра, таблетки ×28
покрытые пленочной оболочкой, Байер Хелскер, Германия • По рецепту
Минск
Каталог

ФТГ: Контрацептивное средство (эстроген + прогестаген)
Цены в аптеках: Минск
Препарат Клайра® — это гормональный контрацептивный препарат, содержащий комбинацию действующих веществ диеногеста, микро и эстрадиола валерата, микро 20, предназначенный для предупреждения нежелательной беременности.
Препарат Клайра® показан в качестве пероральной контрацепции у женщин после наступления менархе (первой менструации).
Препарат Клайра® показан для лечения обильных и/или длительных менструальных кровотечений (не вызванных каким-либо видимым/явным заболеванием матки, т.е. которое не выявляется при использовании дополнительных методов обследования, например УЗИ) у женщин, желающих применять пероральные контрацептивы.
В набор таблеток Клайра® входит 2 темно-желтых таблетки, 5 розовых таблеток, 17 бледно-желтых таблеток, 2 красных таблетки и 2 белых таблетки (всего 28 таблеток). Каждая из 26 таблеток, покрытых цветной оболочкой, содержит небольшое количество женских половых гормонов, либо эстрадиола валерата, либо эстрадиола валерата в сочетании с диеногестом. Каждая из 2 белых таблеток содержит лактозы моногидрат, в этих таблетках гормоны отсутствуют.
Поскольку в состав контрацептивного препарата Клайра® входит два разных гормона, его относят к так называемым «комбинированным пероральным контрацептивам».
Способ действия препарата Клайра®
Контрацептивный эффект препарата Клайра® осуществляется посредством взаимодополняющих механизмов, наиболее важными из которых являются подавление овуляции (выход яйцеклетки из фолликула); повышение вязкости секрета шейки матки, препятствующее проникновению сперматозоидов в полость матки, и изменения в эндометрии (внутренний слой матки), препятствующие имплантации (прикрепление к эндометрию) оплодотворенной яйцеклетки.
У женщин, принимающих препарат Клайра®, уменьшаются болезненность и интенсивность менструальноподобных кровотечений, в результате чего снижается риск железодефицитной анемии.
Не принимайте препарат Клайра®, если:
У Вас есть любое из перечисленных ниже заболеваний. Если любое из перечисленных заболеваний применимо к Вам, то сообщите об этом своему врачу до начала приема препарата Клайра®. Он может посоветовать Вам принимать другой тип таблеток или принципиально иной способ предохранения от нежелательной беременности (включая негормональный).
- у Вас аллергия на действующие вещества или любые другие компоненты препарата (перечисленные в разделе «Состав» листка-вкладыша);
- у Вас есть (или когда-либо был) венозный тромбоз (образование тромба в вене) или тромбоэмболия (закупорка сосуда оторвавшимся тромбом), в том числе, тромбоз глубоких вен, тромбоэмболия легочной артерии (закупорка легочной артерии оторвавшимся тромбом);
- у Вас есть (или когда-либо был) артериальный тромбоз (образование тромба в артерии) или тромбоэмболия, в том числе, инфаркт миокарда, инсульт; или заболевания, которые могут быть предвестниками инсульта или инфаркта (транзиторная ишемическая атака или стенокардия (сильная боль в груди), соответственно);
- у Вас есть наследственные или приобретенные нарушения свертывающей системы крови (например, резистентность к активированному протеину С, гипергомоцистеинемия, дефицит антитромбина Ш, дефицит протеина С, дефицит протеина S, антифосфолипидные антитела ~ антитела к кардиолипину, волчаночный антикоагулянт), которые могут привести к венозному или артериальному тромбозу (см. подраздел «Препарат Клайра® и тромбоз»);
- у Вас есть высокий риск возникновения венозной или артериальной тромбоэмболии ввиду наличия множественных факторов риска (см. подраздел «Препарат Клайра® и тромбоз») или одного серьезного фактора риска, как:
• сахарный диабет с сосудистыми осложнениями;
• неконтролируемая артериальная гипертензия (т.е. Вы не получаете должного лечения повышенного артериального давления);
• тяжелая дислипопротеинемия (нарушение соотношения липидов (жиров) в крови);
- у Вас планируются или недавно были проведены объемные оперативные вмешательства с длительной обездвиженностью или имеется обширная травма (например, если Ваша нога или ноги в гипсе или наложены шины);
- у Вас есть (или когда-либо была) мигрень (с так называемой очаговой неврологической симптоматикой, такой как нарушение зрения, речи, слабость или оцепенение в любой части тела);
- Вы страдаете тяжелым заболеванием печени (возможные симптомы: пожелтение кожи или зуд всего тела) или у Вас когда-либо было такое заболевание, и проблемы с печенью остались;
- у Вас есть (или когда-либо была) доброкачественная или злокачественная опухоль печени;
- у Вас есть (или когда-либо была) гормонозависимая раковая опухоль (в том числе рак молочной железы или половых органов) или подозрение на нее;
- у Вас есть кровотечение из влагалища неясного происхождение
- Вы беременны или предполагаете такую возможность;
- Вы кормите грудью;
- у Вас непереносимость лактозы, дефицит лактазы, нарушение всасывания глюкозы и/или галактозы.
Если у Вас появился какой-либо из вышеуказанных симптомов в первый раз во время приема препарата Клайра®, прекратите прием и проконсультируйтесь с Вашим лечащим врачом.
Перед приемом препарата Клайра® проконсультируйтесь с лечащим врачом. В некоторых случаях Вам необходимо соблюдать особую осторожность при приеме препарата Клайра® и регулярно проходить обследование у своего врача. Проконсультируйтесь с Вашим врачом до начала приема препарата Клайра®, если к Вам применим хотя бы один из указанных ниже случаев, или если любое из этих состояний возникло или усугубилось во время приема препарата Клайра®:
- Вы курите;
- у Вас избыточный вес;
- у Вас дислипопротеинемия (нарушение соотношения липидов (жиров) в крови);
- у Вас высокое артериальное давление;
- Вы страдаете мигренями без очаговой неврологической симптоматики, такой как нарушение зрения, речи, слабость или оцепенение в любой части тела;
- у Вас есть заболевание клапанов сердца или нарушение сердечного ритма;
- у Вас планируются или недавно были проведены обширные операции без периода длительной обездвиженности;
- у Вас сахарный диабет;
- Вы страдаете системной красной волчанкой (заболевание иммунной системы);
- у Вас гемолитико-уремический синдром (нарушение свертываемости крови, вызывающее заболевания почек);
- у Вас болезнь Крона или язвенный колит (воспалительное заболевание кишечника); Вы страдаете серповидно-клеточной анемией;
- у Вас врожденный ангионевротический отек (отек Квинке);
- у Вас повышенное содержание холестерина или триглицеридов в крови (жиров крови);
- у Вас ранее во время беременности или на фоне приема половых гормонов впервые возникали или ухудшались такие состояния, как холестаз (застой желчи, проявляющийся пожелтением и коричневыми пятнами на коже, зудом), холелитиаз (камни в желчном пузыре), снижение слуха, порфирия (наследственное нарушение пигментного обмена), герпес во время беременности или хорея Сиденгама (неврологическое заболевание);
- Вы недавно родили.
Препарат Клайра® и тромбоз
Тромбоз — это закупорка сосуда (артерии или вены) сгустком крови (тромбом).
Тромбоз иногда возникает в глубоких венах ног (тромбоз глубоких вен). Оторвавшиеся от стенки сосуда тромбы с током крови разносятся по организму и «застревают» в более мелких сосудах, блокируя в них ток крови — это называется венозной тромбоэмболией. В случае, когда тромб закупоривает сосуды в легких, возникает так называемая «тромбоэмболия легких». Очень редко тромбы попадают в сосуды сердца, и тогда возникает инфаркт миокарда (сердечный приступ). Тромбоэмболия сосудов головного мозга приводит к инсульту.
Тромбоз и венозная тромбоэмболия не обязательно возникают из-за приема контрацептивных таблеток. Например, риск этих заболеваний возрастает также при беременности или после родов.
Тромбозы не всегда полностью излечимы. В редких случаях возможны длительные
серьезные последствия, в очень редких - летальный исход (в 1-2% случаев). Важно помнить, что общий риск развития опасных тромбозов при применении препарата Клайра® является низким.
Риск развития венозного и артериального тромбозов и тромбоэмболий повышен у тех, кто начал применять комбинированные пероральные контрацептивы впервые или возобновил прием этих препаратов после перерыва (в 4 недели и более). Риск развития венозной тромбоэмболии максимален в первый год применения комбинированных пероральных контрацептивов, особенно в течение первых 3 месяцев.
Препараты, содержащие такие прогестины, как левоноргестрел, норгестимат или норэтистерон, связаны с самым низким риском развития венозной тромбоэмболии. Препарат Клайра® может иметь аналогичный риск венозной тромбоэмболии.
В целом риск венозной тромбоэмболии у женщин, принимающих любые комбинированные пероральные контрацептивы, выше, чем у женщин, их не принимающих. Тем не менее, следует учитывать, что риск тромбозов и тромбоэмболий при беременности или после родов выше, чем при приеме препаратов с низкой дозой эстрогена, таких как Клайра®.
В крайне редких случаях тромбы могут образоваться в других кровеносных сосудах организма, включая печень, кишечник, почки, мозг или глаз.
Следует прекратить приём таблеток и немедленно проконсультироваться с врачом, если Вы заметили возможные признаки тромбоза, тромбоэмболии, инсульта, нарушения проходимости сосудов или инфаркта миокарда, например: отечность всей ноги или вдоль вены ноги; боль или дискомфорт в ноге, которая ощущается только в вертикальном положении или при ходьбе; локальное повышение температуры, покраснение или изменение окраски кожных покровов ноги; затрудненное или учащенное дыхание; внезапный кашель, в том числе с кровохарканием; острая боль за грудиной, с распространением в спину, челюсть, левую руку; чувство тревоги; сильное головокружение или обморок; учащенное или нерегулярное сердцебиение; внезапная слабость или потеря чувствительности в любой части тела; проблемы с речью и пониманием; внезапная одно- или двухсторонняя потеря зрения; внезапное нарушение походки; внезапная, тяжелая или продолжительная головная боль без видимой причины; сильная боль в животе; холодный пот; тошнота; рвота.
Риск образования тромбов в венах или артериях, венозной тромбоэмболии или инсульта повышается:
- с возрастом;
- если Вы курите (с увеличением количества сигарет или повышением возраста риск возрастает, особенно у женщин старше 35 лет);
- при наличии избыточного веса;
- если кто-то из Ваших ближайших родственников (родители, братья, сестры) в возрасте младше 50 лет перенес тромбоз (тромбоз глубоких вен, легочную тромбоэмболию (закупорка легочной артерии тромбом), инфаркт, инсульт или иной вид тромбоза). В случае наследственной или приобретенной предрасположенности к тромбозу Вам необходимо проконсультироваться с врачом по поводу возможности приема препарата Клайра®;
- если у Вас дислипопротеинемия (нарушение соотношения липидов (жиров) в крови;
- если у Вас высокое артериальное давление;
- если Вы страдаете мигренями;
- если у Вас есть заболевание клапанов сердца или нарушение сердечного ритма;
- в результате обширной операции, иммобилизации или серьезной травмы (например, если Ваша нога или ноги в гипсе или наложены шины). В данных случаях необходимо прекратить прием препарата Клайра® (если операция планируется, рекомендуется прекратить прием по крайней мере за четыре недели до нее) и не возобновлять прием в течение двух недель, пока Вы полностью не встанете на ноги. Временная обездвиженность (например, авиаперелет длительностью более 4 часов) может также являться фактором риска развития венозной тромбоэмболии, особенно при наличии других, описанных ранее факторов риска.
Сразу после рождения ребенка женщины находятся в зоне повышенного риска образования тромбов. Если Вы недавно родили, необходимо проконсультироваться с врачом, как скоро после родов Вы сможете начать прием препарата Клайра®.
У женщин с сочетанием нескольких факторов риска или высокой выраженностью одного из них следует рассматривать возможность их взаимоусиления. В подобных случаях степень повышения риска тромбообразования может оказаться более высокой. В таком случае Ваш врач не назначит Вам таблетки с комбинацией диеногеста и эстрадиола валерата.
Препарат Клайра® и опухоли
Наиболее существенным фактором риска рака шейки матки является хроническая папилломавирусная инфекция. Длительный прием пероральных контрацептивов может повысить риск рака шейки матки, но неизвестно, связано ли это с приемом препарата.
Рак молочной железы чаще диагностируется у женщин, которые используют пероральные комбинированные контрацептивы, чем у женщин, которые их не используют, но неизвестно, связано ли это с приемом препарата. Например, возможно, рак у женщин, принимающих комбинированные контрацептивы, выявляется чаще, потому что такие женщины чаще обследуются. У женщин, когда-либо применявших пероральные комбинированные контрацептивы, выявляются более ранние стадии рака молочной железы, чем у женщин, никогда их не применявших. Частота возникновения рака молочной железы постепенно снижается после прекращения приема гормональных контрацептивов. Важно регулярно проверять грудь, и, если Вы нащупали любые уплотнения, необходимо сразу обратиться к врачу.
В редких случаях на фоне применения пероральных контрацептивов наблюдались доброкачественные опухоли печени, еще реже — рак. В отдельных случаях данные опухоли приводили к опасным для жизни внутренним кровотечениям. Немедленно обратитесь к врачу, если Вас мучают необычно сильные боли в животе.
Другие состояния
Если какое-либо из нижеперечисленных состояний появляется впервые, повторяется или ухудшается перед назначением или во время применения препарата Клайра®, Вам следует сообщить об этом лечащему врачу.
Обязательно сообщите лечащему врачу, если у Вас:
- есть (или у кого-то из членов семьи) гипертриглицеридемия (повышенное содержание жиров крови, так как это может привести к повышению риска возникновения панкреатита при приеме пероральных контрацептивов);
- на фоне приема препарата Клайра® наблюдается стойкое повышение артериального давления. В таком случае Вам следует прекратить прием пренарата Клайра® и обратиться к врачу для назначения лечения повышенного артериального давления. Вы сможете продолжить прием препарата, когда с помощью лечения будут достигнуты нормальные значения артериального давления;
- ранее во время беременности или предшествующего применения половых гормонов возникали следующие состояния: желтуха и/или зуд, связанные с холестазом (блокировка потока желчи); образование камней в желчном пузыре; порфирия (наследственное нарушение пигментного обмена); системная красная волчанка (хроническое аутоиммунное заболевание); гемолитико-уремический синдром (нарушение свертываемости крови); хорея Сиденгама (неврологическое заболевание), герпес во время беременности; потеря слуха, связанная с отосклерозом;
- на фоне приема препарата Клайра® наблюдается ухудшение течения эндогенной депрессии (психическое расстройство, связанное с нарушением обменных: процессов в головном мозге), эпилепсии, болезни Крона и язвенного колита (воспалительное заболевание кишечника);
- наследственный ангионевротический отек (внезапный отек, например век, рта, горла и т.п.), так как эстрогены могут вызывать или ухудшать симптомы ангионевротического отека;
- имеются острые или хронические нарушения функции печени, в таком случае Ваш врач может отменить прием препарата Клайра® до нормализации показателей функции печени;
- рецидив холестатической желтухи, которая развилась впервые во время предшествующей беременности или предыдущего приема половых гормонов. В таком случае Вам требуется немедленно прекратить прием препарата Клайра®;
- сахарный диабет. В этом случае Вы должны будете находиться под тщательным наблюдением во время приема препарата Клайра®. В редких случаях комбинированные пероральные контрацептивы могут оказывать влияние на инсулинорезистентность и толерантность к глюкозе, однако необходимости в коррекции дозы гипогликемических препаратов у пациенток с сахарным диабетом, применяющих низкодозированные комбинированные пероральные контрацептивы (<0,05 мг этинилэстрадиола), как правило, не возникает;
- имеется хроническая сердечная или почечная недостаточность, Вы должны будете находиться под тщательным медицинским наблюдением;
- есть или когда-либо была хлоазма (гиперпигментация кожи), особенно во время предшествующей беременности, Вам следует избегать длительного пребывания на солнце или ультрафиолетового излучения во время приема препарата Клайра®.
Влияние на лабораторные тесты
Если Вам нужно сдать анализ крови или сделать другие лабораторные исследования, скажите своему врачу, что Вы принимаете таблетки, поскольку гормональные контрацептивы могут влиять на результаты некоторых анализов.
План медицинских осмотров перед и во время приема препарата Клайра®
Перед началом (или возобновлением) приема препарата Клайра® необходимо предоставить врачу информацию об имеющихся и перенесенных заболеваниях, а также о наличии заболеваний у членов семьи, пройти тщательное общемедицинское и гинекологическое обследование, а также следует убедиться в отсутствии беременности. Контрольные осмотры необходимы по рекомендации врача, но не реже 1 раза в 6 месяцев.
Вам необходимо иметь в виду, что препарат не предохраняет от ВИЧ-инфекции (СПИД) и других заболеваний, передающихся половым путем!
Снижение эффективности
Эффективность препарата Клайра® может быть снижена: при пропуске приема таблеток с гормонами, желудочно-кишечных расстройствах во время приема таблеток с гормонами или в результате лекарственного взаимодействия (см. раздел «Другие препараты и данный препарат» и раздел «Применение»).
Частота и выраженность менструальноподобных кровотечений
На фоне применения препарата Клайра®, особенно в первые месяцы применения, могут возникать нерегулярные менструальноподобные кровотечения («мажущие» выделения или «прорывные» кровотечения). Следует применять средства гигиены и продолжать приём таблеток, как обычно. Нерегулярные кровотечения обычно прекращаются после того, как Ваш организм адаптируется к препарату (обычно после 3 месяцев приема таблеток). Если кровотечения продолжаются, становятся сильнее или начинаются снова, проконсультируйтесь с Вашим лечащим врачом.
Отсутствие очередного менструальноподобного кровотечения
Если Вы правильно принимали все таблетки, у Вас не было рвоты или диареи, и Вы не принимали никакие другие лекарственные средства, маловероятно, что Вы беременны. Продолжайте прием Клайра® в обычном режиме. Тем не менее, при несоблюдении режима приема препарата Клайра® или отсутствии двух подряд кровотечений отмены (менструальноподобное кровотечение в конце упаковки или начале следующей), Вам следует обратиться к врачу. Не начинайте прием следующей упаковки, пока не убедитесь в отсутствии беременности.
Дети и подростки
Данные по эффективности и безопасности по применению препарата у девочек- подростков до 18 лет отсутствуют (подробнее о способе применения у пациенток до 18 лет см. раздел «Применение»).
Препарат Клайра® содержит лактозу
Если у Вас имеется непереносимость некоторых сахаров, перед применением данного лекарственного препарата следует сообщить об этом Вашему лечащему врачу.
Сообщите лечащему врачу о том, что Вы принимаете, недавно принимали или можете начать принимать какие-либо другие препараты. Вы также должны сообщать о том, что Вы принимаете препарат Клайра®, любому другому врачу, который назначает Вам какие-либо лекарственные средства. Они могут сообщить Вам о необходимости использования дополнительных мер контрацепции (например, презервативов) и, если такая необходимость есть, то в течение какого времени Вам следует их применять, или, должен ли быть отменен прием другого лекарственного препарата, в котором Вы нуждаетесь.
Некоторые лекарственные препараты могут влиять на содержание препарата Клайра® в крови, снижать его эффективность в предотвращении нежелательной беременности и вызывать неожиданные кровотечения.
К ним относятся:
• лекарственные средства, используемые для лечения:
- эпилепсии (например, примидон, фенитоин, барбитураты, карбамазепин, окскарбазепин, топирамат, фелбамат);
- туберкулеза (например, рифампицин):
- ВИЧ и вируса гепатита С (так называемые ингибиторы протеазы и ненуклеозидные ингибиторы обратной транскриптазы);
- грибковых инфекций (например, гризеофульвин, итраконазол, вориконазол, флуконазол);
- бактериальных инфекций (макролидные антибиотики, например, кларитромицин, эритромицин);
- определенных сердечных заболеваний, высокого артериального давления (блокаторы кальциевых каналов, например, верапамил, дилтиазем; бозентан).
• препараты, содержащие зверобой продырявленный.
Клайра® может влиять на действие других лекарственных средств, например:
• циклоспорина (иммунодепрессант);
• ламотриджина (лечение эпилепсии).
Препарат Клайра® с пищей и напитками
Вы можете принимать препарат Клайра® вне зависимости от приема пищи, при необходимости его можно запить небольшим количеством воды. Не принимайте препарат Клайра® вместе с грейпфрутовым соком.
Прием препарата Клайра® во время беременности и в период грудного вскармливания противопоказан. Если Вы беременны или кормите грудью, думаете, что забеременели, или планируете беременность, перед началом применения препарата проконсультируйтесь с лечащим врачом.
Беременность
Если беременность выявлена во время приема препарата Клайра®, Вам следует сразу же прекратить прием препарата и обратиться к своему врачу. Если Вы планируете беременность, Вы можете прекратить прием препарата Клайра® в любое время (см. также в разделе «Применение» подраздел «Если Вы хотите прекратить прием препарата Клайра®»). Многочисленные исследования не выявили увеличения риска возникновения дефектов развития у детей, рожденных женщинами, получавшими половые гормоны до беременности или когда половые гормоны принимались по неосторожности в ранние сроки беременности.
Грудное вскармливание
Прием препарата Клайра® противопоказан до прекращения грудного вскармливания. Проконсультируйтесь с врачом, когда можно начать прием препарата.
Нет данных о влиянии препарата на способность к управлению транспортными средствами, механизмами и занятиями потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты реакций.
Всегда принимайте препарат Клайра® в полном соответствии с рекомендациями лечащего врача. При появлении сомнений посоветуйтесь с лечащим врачом.
Рекомендуемая доза:
по 1 таблетке в сутки последовательно в течение 28 дней.
Путь и (или) способ введения
Принимайте таблетки внутрь по порядку, указанному на упаковке, каждый день в одно и то же время, не разжевывая, вне зависимости от приема пищи, при необходимости запивая небольшим количеством воды. Вы можете принимать таблетки как вместе с едой, так и без нее.
Кровотечение «отмены» обычно начинается во время приема последних таблеток календарной упаковки (второй красной таблетки или белых таблеток) и может еще не завершиться до начала приема таблеток из следующей календарной упаковки. У некоторых женщин кровотечение продолжается после приема первых таблеток из новой календарной упаковки.
Начните прием следующей упаковки без перерыва, другими словами, на следующий день после того, как Вы закончили прием текущей упаковки, даже если кровотечение не остановилось. Это означает, что Вы должны начать прием следующей упаковки в тот же день недели, что и первую таблетку текущей упаковки, и что кровотечение «отмены» должно происходить каждый месяц в одни и те же дни.
Если Вы используете препарат Клайра® в соответствии с данными рекомендациями, то Вы защищены от беременности даже в течение 2-х дней, когда Вы принимаете неактивные таблетки.
Пациентки пожилого возраста
Препарат Клайра® не следует принимать после наступления менопаузы (последняя менструация в жизни).
Пациентки с нарушением функции печени
Не принимайте препарат Клайра®, если у Вас есть тяжелое заболевание печени до тех пор, пока показатели функции печени не придут в норму (см. раздел «Противопоказания»).
Пациентки с нарушением функции почек
Препарат Клайра® специально не изучался у пациенток с нарушениями функции почек. Имеющиеся данные не предполагают коррекции режима дозирования у таких пациенток.
Применение у детей и подростков
Препарат Клайра® не следует принимать, если у Вас еще не начались месячные.
Как обращаться с упаковкой препарата Клайра®
Раскладывающаяся упаковка содержит блистер с таблетками и 7 самоклеящихся полосок с отмеченными на них названиями дней недели.
Выберите полоску, которая начинается со дня начала приема таблеток. Например, если Вы начинаете прием таблеток в среду, используйте полоску, которая начинается со «Ср.». Наклейте полоску непосредственно над таблетками, где расположена надпись «Сюда наклеить календарь», так, чтобы первый день приема находился над таблеткой с отметкой «1». Таким образом Вы увидите, в какой день недели следует принять каждую таблетку (над каждым столбцом таблеток отображается соответствующий день недели). Вы также можете увидеть, принимали ли Вы таблетку в конкретный день. Следуйте направлению стрелки на книжке-раскладушке, пока не будут приняты все 28 таблеток.
Когда начать прием таблеток из первой упаковки?
• Если Вы не применяли гормональные контрацептивы в предыдущем месяце
Начинайте принимать препарат Клайра® в первый день менструального цикла (то есть в первый день месячных).
• При переходе с других комбинированных пероральных контрацептивов, вагинального кольца или трансдермального пластыря
Начните прием препарата Клайра® на следующий день после приема последней таблетки, содержащей гормоны из предыдущей упаковки комбинированного перорального контрацептива. Если Ваша предыдущая упаковка содержит таблетки без гормонов, утилизируйте их и продолжайте прием своей первой упаковки препарата Клайра® без перерыва. При переходе с комбинированного противозачаточного вагинального кольца или пластыря начните использовать препарат Клайра® в день удаления кольца или пластыря.
• При переходе с контрацептивов, содержащих только гестаген («мини-пили», инъекционные формы, имплантат), или с внутриматочной терапевтической системы с высвобождением гестагена
Вы можете перейти с «мини-пили» на препарат Клайра® в любой день (без перерыва), с имплантата или внутриматочного контрацептива с высвобождением гестагена — в день его удаления, с инъекционной формы — со дня, когда должна была быть сделана следующая инъекция. Во всех случаях в течение первых 9 дней приема таблеток препарата Клайра® необходимо использовать дополнительный барьерный метод контрацепции (например, презерватив).
• После аборта в первом триместре беременности
Вы можете начать прием таблеток немедленно (в день выполнения аборта). В этом случае в дополнительных мерах контрацепции нет необходимости.
• После родов или прерывания беременности (в том числе самопроизвольного) во втором триместре
Начинать прием препарата следует на 21-28 день после родов (при отсутствии грудного вскармливания) или сразу после прерывания беременности (в том числе самопроизвольного) во втором триместре. Если прием препарата Вы начали позднее, то необходимо использовать дополнительно барьерный метод контрацепции в течение первых 9 дней приема таблеток.
Если половой контакт имел место до начала приема препарата Клайра®, Вы должны сначала убедиться, что Вы не беременны или подождать до следующей менструации.
Всегда принимайте препарат в полном соответствии с рекомендациями лечащего врача. Если Вы не уверены, когда Вам следует начать прием препарата, спросите своего врача.
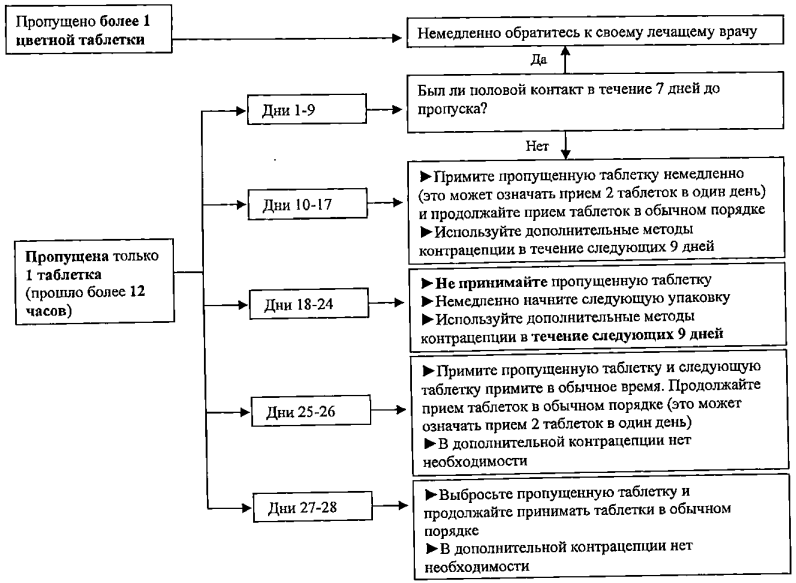
Если Вы забыли принять препарат Клайра®
В зависимости от дня цикла, в который была пропущена одна таблетка, Вам может потребоваться принять дополнительные меры контрацепции, например, презерватив. В случае сомнений, обратитесь к Вашему врачу.
• Если Вы забыли принять любую из 2 таблеток без гормонов (белые таблетки в последнем ряду «книжки-раскладушки»), Вы все равно защищены от беременности, потому что они не содержат никаких гормонов. Однако, пропущенные таблетки следует выбросить, чтобы случайно не продлить период приема таблеток без гормонов.
Следующие рекомендации относятся к цветным таблеткам (содержащим гормоны) (таблетки 1-26 Вашей «книжки-раскладушки»):
• Если Вы опоздали менее чем на 12 часов в приеме таблетки, защита от беременности не снижается. Примите пропущенную таблетку сразу, как только вспомните о ней, а следующие таблетки принимайте в обычное время.
• Если Вы опоздали с приемом одной таблетки более чем на 12 часов, контрацептивная защита от беременности может быть снижена. Примите последнюю пропущенную таблетку сразу, как только вспомните об этом, даже если это будет означать, что Вам придется выпить 2 таблетки одновременно, но не больше.
В зависимости от дня менструальноподобного цикла, в который была пропущена таблетка (подробнее см. Таблицу 1 и схему с рекомендациями действий в случае пропуска таблеток), Вам требуется применять дополнительные меры контрацепции (например, барьерный метод предохранения, в частности презервативы) в соответствии со следующими рекомендациями:
Таблица 1. Рекомендации е случае пропуска 1 таблетки
| ДЕНЬ | Цвет / Содержание эстрадиола валерата (ЭВ) и диеногеста (ДНГ) | Рекомендации, которым требуется следовать, если была пропущена одна таблетка, и прошло более 12 часов: |
| 1-2 | Темно-желтые таблетки (3,0 мг ЭВ) | -
Примите пропущенную таблетку немедленно, а следующую таблетку - в обычное
время (даже если это означает, что придется принять 2 таблетки в один день); - Продолжайте принимать таблетки в обычном порядке; - Дополнительные меры контрацепции в течение последующих 9 дней; |
| 3-7 |
Розовые таблетки
(2,0 мг ЭВ + 2,0 мг ДНГ) |
|
| 8-17 | Бледно-желтые таблетки (2,0 мг ЭВ+ 3,0 мгДНГ) | |
| 18-24 | Бледно-желтые таблетки (2,0 мг ЭВ+ 3,0 мгДНГ) |
- Выбросите текущую календарную упаковку и немедленно
начните прием с первой таблетки из новой календарной упаковки;
- Продолжайте принимать таблетки в обычном порядке; - Дополнительные меры контрацепции в течение последующих 9 дней; |
| 25-26 | Красные таблетки (1,0 мг ЭВ) |
- Немедленно примите
пропущенную таблетку, а следующую таблетку - в обычное время (даже если это
означает, что придется принять 2 таблетки в один день);
- В дополнительных мерах контрацепции нет необходимости; |
| 27-28 | Белые таблетки (Плацебо) | - Выбросите пропущенную таблетку и продолжайте прием таблеток в обычном порядке; - В дополнительных мерах контрацепции нет необходимости. |
Допускается принимать не более 2 таблеток в один день.
Обратитесь к Вашему врачу, если Вы забыли принять больше 1 таблетки.
Если Вы забыли начать новую календарную упаковку или пропустили одну или более таблеток с 3-го по 9-ый день календарной упаковки, Вы уже можете быть беременны (в том случае, если у Вас был половой контакт в течение 7 дней перед пропуском таблетки). Чем больше таблеток (особенно с комбинацией диеногеста и эстрадиола валерата в дни с 3-го по 24-ый) пропущено, и чем ближе они к приему таблеток, не содержащих гормоны (белых), тем выше вероятность беременности. Если Вы пропускали прием таблеток, и затем в конце календарной упаковки/в начале новой календарной упаковки менструально подобное кровотечение у Вас не наступило, необходимо удостовериться в отсутствии беременности (см. раздел «Особые указания и меры предосторожности», подраздел «Отсутствие очередного менструальноподобного кровотечения»).
Для удобства данная информация представлена в виде следующей схемы:
Что делать, если у Вас рвота или сильное расстройство желудка
Если у Вас рвота или сильное расстройство желудка после приема любой из 26 цветных гормоне содержащих таблеток, то всасывание препарата может быть неполным. Если в течение 3-4 часов после приема таблетки произойдет рвота или диарея, следует ориентироваться на рекомендации при пропуске таблеток (см. подраздел «Если Вы забыли принять препарат Клайра®»). Если Вы не хотите менять свою обычную схему приема, дополнительную таблетку того же цвета следует принять из другой упаковки. При появлении сомнений проконсультируйтесь с врачом. Рвота или диарея при приеме 2 последних белых таблеток не содержащих гормонов не влияет на надежность контрацепции.
Если вы прекратили прием препарата Клайра®
Вы можете прекратить прием препарата Клайра® в любое время. Если Вы не планируете беременность, спросите своего врача о надежных методах контрацепции. Если планируется беременность, следует просто прекратить прием препарата Клайра®, дождаться естественного менструального кровотечения, и уже потом пытаться забеременеть. Это поможет более точно рассчитать срок беременности и время родов. При наличии вопросов по применению препарата обратитесь к лечащему врачу.
О серьезных вредных последствиях в результате передозировки препарата Клайра® не сообщалось.
При передозировке могут отмечаться: тошнота, рвота. У девочек-подростков могут наблюдаться вагинальные кровотечения.
Если Вы приняли препарата Клайра® больше, чем следовало или обнаружили, что таблетку проглотил ребенок, обратитесь к лечащему врачу.
Подобно всем лекарственным препаратам препарат Клайра® может вызывать нежелательные реакции, однако они возникают не у всех.
Редкими, но серьезными нежелательными реакциями являются артериальная и венозная тромбоэмболия и рак (см. также в разделе «Особые указания и меры предосторожности» подразделы «Препарат Клайра® и тромбоз» и «Препарат Клайра® и опухоли»). В случае возникновения возможных признаков тромбоза или рака немедленно обратитесь к своему лечащему врачу. Вам может потребоваться немедленная медицинская помощь!
Ниже приведены возможные нежелательные реакции в зависимости от частоты их возникновения:
Часто
(могут возникать не более чем у 1 человека из 10)
- головная боль; боль в области пазух носа
- боли в животе; вздутие живота; тошнота
- акне
- отсутствие менструальноподобных кровотечений, метроррагия (нерегулярные менструальноподобные кровотечения)
- болезненное менструальноподобное кровотечение
- дискомфорт в молочных железах, боли в молочных железах, болезненность сосков, боли в сосках
- повышение массы тела
Нечасто
(могут возникать не более чему 1 человека из 100)
- грибковая инфекция
- инфекция влагалища неуточненная
- кандидозный вульвовагинит (молочница во влагалище)
- повышение аппетита
- головокружение
- мигрень с аурой/без ауры
- депрессия/снижение настроения
- снижение либидо (снижение полового влечения)
- психическое нарушение
- перепады настроения; аффективная лабильность (перепады настроения)
- бессонница
- повышение артериального давления
- «приливы»
- диарея
- рвота
- повышение активности аланинаминотрансферазы, аспартатаминотрансферазы гамма-глутамилтрансферазы («печеночных» ферментов)
- алопеция (выпадение волос)
- зуд, в т.ч. генерализованный зуд и зудящая сыпь; сыпь, в т.ч. пятнистая сыпь
- гипергидроз (обильное потоотделение)
- мышечные спазмы
- увеличение молочных желез; диффузное уплотнение молочных желез
- дисплазия эпителия шейки матки (патологические клетки на поверхности шейки матки)
- дисфункциональное маточное кровотечение
- диспареуния (боль во время полового акта)
- фиброзно-кистозная мастопатия (доброкачественное изменение молочных желез)
- обильное менструальноподобное кровотечение
- киста в яичниках
- боли в тазовой области
- предменструальноподобный синдром
- лейомиома матки
- спазм мышц матки
- выделения из влагалища; сухость слизистой оболочки вульвы и влагалища
- кровянистые выделения/кровотечения из влагалища, в т.ч. «мажущие» выделения
- раздражительность
- периферические отеки
- снижение массы тела
- утомляемость
- повышение или снижение артериального давления
Редко
(могут возникать не более чему 1 человека из 1000)
- кандидоз (грибковая инфекция); синдром гистоплазмоза глаз (грибковая инфекция глаз)
- оральный герпес
- опоясывающий лишай
- инфекции мочевыводящих путей
- бактериальный вагинит
- воспалительные заболевания органов малого таза
- лимфаденопатия (увеличение размера лимфоузлов)
- задержка жидкости
- гипертриглицеридемия (повышенное содержание жиров крови)
- нарушение внимания
- парестезия (нарушение чувствительности)
- вертиго (головокружение)
- агрессивность
- тревожность; нервозность; беспокойство
- дисфория (пониженное настроение со склонностью к вспышкам агрессии)
- повышение либидо
- нарушение сна; стресс
- непереносимость контактных линз; сухость слизистой оболочки глаз
- отек век
- инфаркт миокарда
- ощущение сердцебиения
- кровотечение из варикозно расширенных вен
- снижение артериального давления
- боли по ходу вен; венозная тромбоэмболия; артериальная тромбоэмболия, флебит (воспаление) поверхностных вен; тромбофлебит
- бронхиальная астма; одышка
- носовое кровотечение
- запор; диспепсия (нарушение деятельности желудка)
- гастроэзофагеальный рефлюкс (обратное продвижение содержимого желудка в пищевод)
- сухость во рту
- фокальная нодулярная гиперплазия печени (очаговое образование в печени)
- хронический холецистит
- аллергическая кожная реакция, включая аллергический дерматит и крапивницу
- хлоазма (гиперпигментация кожи)
- дерматит; нейродерматит
- гирсутизм (избыточное оволосение по мужскому типу - усы, борода)
- гипертрихоз (избыточный рост волос)
- нарушение пигментации
- себорея (воспалительное заболевание кожи из-за повышенного выделения кожного сала)
- поражение кожи, в т. ч. нарушение тургора кожи (упругость и эластичность кожи)
- боли в спине
- ощущение тяжести
- боль в челюсти
- боль в области мочевыводящих путей
- доброкачественное новообразование в молочной железе, в том числе киста молочной железы
- рак молочной железы
- полип шейки матки
- кровотечение во время полового сношения
- галакторея (патологическое выделение грудного молока молочными железами)
- скудные кровянистые менструальноподобные выделения
- задержка менструальноподобного кровотечения
- разрыв кисты яичника
- ощущение жжения во влагалище
- запах из влагалища
- вульвовагинальный дискомфорт
- боль в груди
- недомогание
- лихорадка
- патологические результаты цитологического исследования по Папаниколау
Описание отдельных нежелательных реакций
Ниже перечислены нежелательные реакции с неизвестной частотой встречаемости или с задержкой начала проявления симптомов, для которых выявлена связь с группой комбинированных пероральных контрацептивов (см. также в разделе «Противопоказания», «Особые указания и меры предосторожности»):
Опухоли
• У женщин, применяющих комбинированные пероральные контрацептивы, очень незначительно повышена частота выявления рака молочной железы. Поскольку рак молочной железы редко встречается у женщин в возрасте моложе 40 лет, повышенное число случаев его возникновения незначительно относительно риска возникновения рака молочной железы в целом. Причинно-следственная связь с приемом комбинированных пероральных контрацептивов не доказана (см. подраздел «Препарат Клайра® и опухоли»)
• Опухоли печени (доброкачественные и злокачественные)
Другие состояния
• Артериальные и венозные тромбозы и тромбоэмболические осложнения
• Узловатая эритема (заболевание кожи, характеризующееся болезненными красными узлами), мультиформная эритема
• Выделения из молочной железы
• Женщины с гипертриглицеридемией (увеличение содержания жиров крови, приводящее к повышению риска возникновения панкреатита при приеме пероральных контрацептивов)
• Высокое артериальное давление
• Состояния, развивающиеся или ухудшающиеся во время приема комбинированных контрацептивов, но их связь не доказана: желтуха и/или зуд, связанные с холестазом (блокировка потока желчи); образование камней в желчном пузыре; порфирия (наследственное нарушение пигментного обмена); системная красная волчанка (хроническое аутоиммунное заболевание); гемолитико-уремический синдром (нарушение свертываемости крови); хорея Сиденгама (неврологическое заболевание); герпес во время беременности; потеря слуха, связанная с отосклерозом; эпилепсия
• Наследственный ангионевротический отек (внезапный отек, например век, рта, горла и т.п.). Прием эстрогенов может вызывать или ухудшать симптомы ангионевротического отека
• Нарушение функции печени
• Изменения толерантности к глюкозе (снижение способности правильно усваивать глюкозу) или влияние на периферическую инсулинорезистентность (снижение биологического ответа к эффектам действия инсулина)
• Болезнь Крона, язвенный колит (воспалительное заболевание кишечника)
• Хлоазма (золотисто-коричневые пятна на коже, особенно на лице)
• Гиперчувствительность (включая такие симптомы, как сыпь, крапивница)
Взаимодействия
Взаимодействие препарата Клайра® с другими лекарственными препаратами может привести к неожиданным кровотечениям и/или снижению контрацептивного эффекта (см. в разделе «Другие препараты и данный препарат»).
Сообщение о нежелательных реакциях
Если у Вас возникают какие-либо нежелательные реакции, проконсультируйтесь с лечащим врачом. Данная рекомендация распространяется на любые возможные нежелательные реакции, в том числе на не перечисленные в листке-вкладыше. Вы также можете сообщить о нежелательных реакциях напрямую (см. ниже). Сообщая о нежелательных реакциях, Вы помогаете получить больше сведений о безопасности лекарственного препарата.
Российская Федерация
Адрес: 109012, Москва, Славянская площадь, д. 4, стр. 1
Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор)
Телефон горячей линии: +7 800 550 99 03
Электронная почта: pharm@roszdravnadzor.gov.ru
http://roszdravnadzor.gov.ru
Республика Казахстан
Адрес: 010000, г. Астана, район Байконыр, ул. А.Иманова, 13 (ВЦ «Нурсаулет 2»)
«Национальный центр экспертизы лекарственных средств и медицинских изделий»
Комитета медицинского и фармацевтического контроля Министерства
Здравоохранения Республики Казахстан Телефон:+ 7 7172 23 51 35
Электронная почта: farm@dari.kz
http://www.ndda.kz
Республика Беларусь
Адрес: 220037, г. Минск, Товарищеский пер., 2а
РУП «Центр экспертиз и испытаний в здравоохранении»
Телефон отдела фармаконадзора: +375 17 242 00 29
Электронная почта: rcpl@rceth.by
http://www.rceth.by
Храните препарат в недоступном для ребенка месте так, чтобы ребенок не мог увидеть его.
Не принимайте препарат после истечения срока годности (срока хранения), указанного на упаковке. Датой истечения срока годности является последний день данного месяца.
Храните при температуре не выше 30°С.
Не выбрасывайте препарат в канализацию (водопровод). Уточните у работника аптеки, как следует утилизировать (уничтожать) препарат, который больше не потребуется. Эти меры позволят защитить окружающую среду.
Препарат Клайра® содержит
Действующими веществами являются диеногест, микро и эстрадиола валерат, микро 20.
Каждая темно-желтая таблетка, покрытая пленочной оболочкой, содержит эстрадиола валерата, микро 20 — 3,000 мг.
Прочими ингредиентами (вспомогательными веществами) являются:
ядро таблетки: лактозы моногидрат, крахмал кукурузный, крахмал кукурузный прежелатинизированный, повидон-25, магния стеарат.
пленочная оболочка: гипромеллоза, макрогол-6000, тальк, титана диоксид, краситель железа оксид желтый.
Каждая розовая таблетка, покрытая пленочной оболочкой, содержит эстрадиола валерата, микро 20 - 2,000 мг и диеногеста, микро - 2,000 мг.
Прочими ингредиентами (вспомогательными веществами) являются:
ядро таблетки: лактозы моногидрат, крахмал кукурузный, крахмал кукурузный прежелатинизированный, повидон-25, магния стеарат.
пленочная оболочка: гипромеллоза, макрогол-6000, тальк, титана диоксид, краситель железа оксид красный.
Каждая бледно-желтая таблетка, покрытая пленочной оболочкой, содержит эстрадиола валерата, микро 20 - 2,000 мг и диеногеста, микро - 3,000 мг.
Прочими ингредиентами (вспомогательными веществами) являются:
ядро таблетки: лактозы моногидрат, крахмал кукурузный, крахмал кукурузный прежелатинизированный, повидон-25, магния стеарат.
пленочная оболочка: гипромеллоза, макрогол-6000, тальк, титана диоксид, краситель железа оксид желтый.
Каждая красная таблетка, покрытая пленочной оболочкой, содержит эстрадиола валерата, микро 20 - 1,000 мг.
Прочими ингредиентами (вспомогательными веществами) являются:
ядро таблетки: лактозы моногидрат, крахмал кукурузный, крахмал кукурузный прежелатинизированный, повидон-25, магния стеарат.
пленочная оболочка: гипромеллоза, макрогол-6000, тальк, титана диоксид, краситель железа оксид красный.
Каждая белая таблетка, покрытая пленочной оболочкой, содержит прочие ингредиенты (вспомогательные вещества):
ядро таблетки: лактозы моногидрат, крахмал кукурузный, повидон-25, магния стеарат, пленочная оболочка: гипромеллоза, тальк, титана диоксид.
Препарат Клайра® содержит лактозы моногидрат (см. раздел «Особые указания и меры предосторожности»).
Клайра®, темпо-желтые таблетки, покрытые пленочной оболочкой:
Круглые двояковыпуклые таблетки, покрытые пленочной оболочкой, темно-желтого цвета, с гравировкой “DD” в правильном шестиугольнике на одной стороне.
Клайра®, розовые таблетки, покрытые пленочной оболочкой:
Круглые двояковыпуклые таблетки, покрытые пленочной оболочкой, розового цвета, с гравировкой “DJ” в правильном шестиугольнике на одной стороне.
Клайра®, бледно-желтые таблетки, покрытые пленочной оболочкой:
Круглые дно я ко выпуклые таблетки, покрытые пленочной оболочкой, бледно-желтого цвета, с гравировкой “ОН” в правильном шестиугольнике на одной стороне.
Клайра®, красные таблетки, покрытые пленочной оболочкой:
Круглые двояковыпуклые таблетки, покрытые пленочной оболочкой, красного цвета, с гравировкой “DN” в правильном шестиугольнике на одной стороне.
Клайра®, белые таблетки, покрытые пленочной оболочкой:
Круглые двояковыпуклые таблетки, покрытые пленочной
оболочкой, белого цвета, с гравировкой “DT” в правильном
шестиугольнике на одной стороне.
Препарат Клайра® выпускается:
Набор таблеток, покрытых пленочной оболочкой, 2 мг + 2 мг и 3 мг + 2 мг и 1 мг и 3 мг.
2 темно-желтых таблетки, 5 розовых таблеток, 17 бледно-желтых таблеток, 2 красных таблетки и 2 белых таблетки (всего 28 таблеток) в одном блистере из пленки ПВХ и алюминиевой фольги.
1 блистер вклеен в книжку-раскладушку картонную. 1 или 3 книжки-раскладушки вместе с самоклеящимся календарем приема и листком-вкладышем запечатаны в прозрачную пленку. На прозрачную пленку наносится упаковочный стикер.
Держатель регистрационного удостоверения
Байер АГ, Кайзер-Вильгельм-Аллее, 1, 51373 Леверкузен,
Герман Bayer AG,
Kaiser-Wilhelm-Allee, 1, 51373 Leverkusen, Germany
Производитель
Байер Веймар ГмбХ и Ко. КГ, Деберайнерштрассе, 20, 99427
Веймар, Германия Bayer Weimar GmbH und
Со. KG,
Dobereinerstrasse 20, 99427 Weimar, Germany
За любой информацией о препарате, а также в случаях
возникновения претензий следует обращаться к местному представителю держателя
регистрационного удостоверения:
Российская Федерация
АО
«БАЙЕР»
107113 Москва, 3-я Рыбинская ул., д. 18, стр. 2, Россия
Тел.:+7 495 231
12 00
www.bayer.ru
Республика
Казахстан
ТОО «Байер КАЗ»
050057 Алматы,
ул. Тимирязева, 42, павильон 15, офис 301, Казахстан
Тел.:+7 727 258 80 40
www.bayer.ru
В
случаях возникновения претензий на территории Республики Беларуси следует
обращаться:
Республика
Беларусь
220089 г. Минск, пр. Дзержинского 57, помещение 54,
Беларусь
Тел.: +375 17 239 54 20
www.bayer.ru
Прочие источники информации
Подробные сведения о данном препарате содержатся на веб-сайт Евразийского Экономического Союза https://eec.eaeunion.org. Листок-вкладыш
доступен на всех языках Союза на веб-сайте Союза.

покрытые пленочной оболочкой, Байер Хелскер, Германия • По рецепту