Эпоцим, раствор, 10 тыс МЕ ×10
для инъекций, Белмедпрепараты, Беларусь • По рецепту
Минск
Каталог
МНН: Эпоэтин альфа
ФТГ: Гемопоэза стимулятор
Цены в аптеках: Минск
В 1 мл раствора для внутривенного и подкожного введения:
Активный компонент: эпоэтин альфа рекомбинантный 40 000 ME (336 мкг).
Вспомогательные вещества: полисорбат 80 - 0,30 мг, натрия хлорид - 4,38 мг, натрия гидрофосфата дигидрат - 2,23 мг, натрия дигидрофосфата дигидрат - 1,16 мг, глицин - 5,00 мг, вода для инъекций - до 1 мл.
Прочие антианемические средства.
Код АТХ - В03ХА01.
Фармакодинамика
Механизм действия
Эритропоэтин представляет собой гликопротеиновый гормон, вырабатывающийся в почках в ответ на гипоксию. Он является основным регулятором образования эритроцитов. Эритропоэтин участвует во всех фазах созревания эритроидных клеток и оказывает основное действие на этапе образования клеток-предшественников эритроцитов. После связывания эритропоэтина с авидными к нему рецепторами на поверхности клеток предшественников эритропоэза происходит активация путей прохождения сигнала, влияющего на апоптоз, и стимуляция пролиферации эритроидных клеток. Экспрессированный в клетках яичника китайского хомячка рекомбинантный человеческий эритропоэтин (эпоэтин альфа) содержит последовательность из 165 аминокислот, идентичную человеческому эритропоэтину в моче. При функциональной оценке оба вещества не различаются. Кажущаяся молекулярная масса эритропоэтина составляет от 32 000 до 40 000 дальтон.
Фармакодинамические реакции на эпоэтин альфа, свободный от человеческого сывороточного альбумина, процентное изменение содержания ретикулоцитов, гемоглобина и общего объёма эритроцитов, а также площадь под кривой зависимости концентрации от времени (AUC) этих фармакодинамических параметров были одинаковы при обоих способах дозировки (от 150 МЕ/кг подкожно 3 раза в неделю до 40 000 МЕ/мл подкожно один раз в неделю).
Препараты, стимулирующие эритропоэз, являются факторами роста, которые в первую очередь стимулируют образование красных кровяных телец. Рецепторы эритропоэтина могут экспрессироваться на клеточной поверхности различных опухолевых клеток.
Клиническая эффективность
Хроническая почечная недостаточность
Эпоэтин альфа был изучен в клинических исследованиях с участием взрослых пациентов с анемией и хронической почечной недостаточностью (ХПН), в том числе у пациентов с потребностью и без потребности в гемодиализе, для лечения анемии и поддержания гематокрита в пределах целевой концентрации 30-36%.
В клинических исследованиях при начальной дозе от 50 до 150 МЕ/кг три раза в неделю клинически значимое увеличение гематокрита было отмечено примерно у 95% всех пациентов. После примерно двух месяцев терапии, переливание не требовалось почти всем пациентам. После достижения целевого уровня гематокрита, поддерживающая доза была подобрана индивидуально.
В трёх крупнейших клинических исследованиях, проведённых среди взрослых пациентов с потребностью в гемодиализе, средняя доза, необходимая для поддержания гематокрита на уровне от 30 до 36%, составляла примерно 75 МЕ/кг 3 раза в неделю.
В многоцентровом двойном слепом плацебо-контролируемом исследовании качества жизни среди пациентов с хронической почечной недостаточностью на гемодиализе, у пациентов, получавших эпоэтин альфа, после шести месяцев лечения было отмечено клинически и статистически значимое улучшение по сравнению с группой плацебо на основании оценки утомляемости, физических симптомов, социальных отношений и депрессии («Анкета при заболеваниях почек»). Пациенты из группы, получавшей эпоэтин альфа, также были включены в открытое исследование с продолжением терапии, в котором было показано улучшение качества жизни, поддерживаемое в течение следующих 12 месяцев.
Для пациентов с хронической почечной недостаточностью (пациентов с потребностью и без потребности в гемодиализе, страдающих и не страдающих сахарным диабетом) были проведены обобщённые апостериорные анализы результатов клинических исследований препаратов, стимулирующих эритропоэз. При повышении общей дозы препаратов, стимулирующих эритропоэз, вне зависимости от потребности в гемодиализе или наличия диабета наблюдалась тенденция к повышению вероятности общей смертности, сердечно-сосудистых и цереброваскулярных симптомов (см. разделы «Способ применения и дозы» и «Меры предосторожности»).
Взрослые пациенты с почечной недостаточностью без потребности в гемодиализе
В клинических исследованиях, проведённых среди пациентов с хронической почечной недостаточностью, не находившихся на гемодиализе и получавших эпоэтин альфа, средняя продолжительность терапии составила почти пять месяцев. У этих пациентов был показан схожий ответ на терапию с применением эпоэтина альфа в сравнении с пациентами, которым проводился гемодиализ. У пациентов с хронической почечной недостаточностью, не находящихся на гемодиализе, было показано устойчивое дозозависимое повышение гематокрита при внутривенном или подкожном введении эпоэтина альфа. Схожие темпы роста гематокрита были отмечены при введении эпоэтина альфа обоими способами. Кроме того, введение эпоэтина альфа в дозе от 75 до 150 МЕ/кг в неделю сопровождалось поддержанием уровня гематокрита в пределах 36-38% длительностью до шести месяцев.
В исследовании по увеличению временных интервалов между инъекциями препарата Эпрекс® (один раз в неделю, один раз в 2 недели) у некоторых пациентов с увеличенным промежутком между инъекциями не поддерживалась достаточная концентрация уровня гемоглобина, и были достигнуты установленные в протоколе критерии прекращения исследования на основании уровня гемоглобина (0% в группе, с введением препарата один раз в неделю, 3,7% в группе с введением препарата один раз в 2 недели).
В рандомизированном проспективном исследовании (CHOIR) были изучены данные 1432 пациентов с анемией и хронической почечной недостаточностью, не получавших гемодиализ. Пациенты были распределены для терапии с применением эпоэтина альфа с целевым уровнем гемоглобина 13,5 г/дл (выше рекомендованного уровня гемоглобина) или 11,3 г/дл. Большая часть сердечно-сосудистых осложнений (смерть, инфаркт миокарда, инсульт или госпитализация в связи с сердечной недостаточностью) были отмечены у 125 (18%) из 715 пациентов в группе с более высоким уровнем гемоглобина по сравнению с 97 (14%) из 717 пациентов в группе с низким уровнем гемоглобина (относительный риск 1,3, 95% доверительный интервал: 1,0,1,7, р = 0,03).
Лечение пациентов с анемией, вызванной химиотерапией (анемия при онкологических заболеваниях)
Эпоэтин альфа был изучен в клинических исследованиях с участием взрослых онкологических пациентов с анемией и лимфоидными или солидными опухолями и у пациентов, получающих различные схемы химиотерапии, в том числе с применением препаратов платины и без них. В этих исследованиях эпоэтин альфа применялся 3 раза в неделю или один раз в неделю. После первого месяца терапии у онкологических больных с анемией обнаружилось повьппение уровня гемоглобина и уменьшение необходимости переливании крови. В некоторых исследованиях после двойной слепой фазы проводилась открытая фаза, во время которой все пациенты получали эпоэтин альфа, при этом наблюдалось сохранение эффекта.
Имеющиеся данные свидетельствуют о том, что у пациентов с немиелоидными гематологическими или солидными опухолями наблюдается похожий гемопоэтический ответ на терапию с применением эпоэтина альфа в сравнении с пациентами с инфильтрацией опухолевых клеток костного мозга или без неё. В исследованиях на группе пациентов, получающих химиотерапию была продемонстрирована сопоставимая интенсивность химиотерапии в группах, получавших эпоэтин альфа и плацебо, с одинаковой площадью под кривой зависимости числа нейтрофильных гранулоцитов от времени у пациентов, получавших эпоэтин альфа и плацебо, а также аналогичной долей пациентов в группах, получавших эпоэтин альфа и плацебо, у которых абсолютное число нейтрофилов снизилось до 1000 и 500 клеток/мкл.
В проспективном рандомизированном двойном слепом плацебо-контролируемом исследовании, проведенном среди 375 пациентов с анемией и различными немиелоидными опухолями, получавших химиотерапию без препаратов платины, наблюдалось статистически значимое сокращение частоты осложнений, связанных с анемией (например утомляемости, снижения работоспособности и уменьшения активности), измеренных с помощью следующих шкал: общая шкала функциональной оценки анемии, вызванной терапией злокачественных новообразований (FACT-An), шкала усталости FACT-An, а также линейная аналоговая шкала оценки рака (CLAS).
В рандомизированном открытом многоцентровом исследовании приняли участие 2098 пациенток с анемией и метастатическим раком молочной железы, проходивших химиотерапию первой или второй линии. Целью этого исследования для доказательства не меньшей эффективности лечения было исключение повышения риска прогрессирования опухоли или смерти на 15% во время терапии эпоэтином альфа в комбинации со стандартной терапией в сравнении со стандартной терапией. Первичная конечная точка, представленная медианой выживаемости без прогрессирования, по оценке прогрессирования заболевания исследователем, составила в обеих группах 7,4 месяца с 841 (80%) случаями прогрессирования в группе комбинированной терапии в сравнении с 818 (78%) случаями прогрессирования в группе стандартной терапии (относительный риск 1,06, 95% доверительный интервал: 0,99, 1,20). Это означает, что цель исследования для доказательства не меньшей эффективности лечения не была достигнута, и что в группе эпоэтина альфа в комбинации со стандартной терапией наблюдалось повьппение риска развития заболевания или смерти на 9%. Медиана выживаемости без прогрессирования, по оценке прогрессирования заболевания Независимым наблюдательным комитетом (с целью оценки корректности результатов), составила в обеих группах 7,6 месяца (относительный риск 1,03, 95% доверительный интервал: 0,92, 1,15). К моменту окончания сбора клинических данных было зарегистрировано 1337 случаев смерти. Медиана общей выживаемости в группе эритропоэтина в комбинации со стандартной терапией составила 17,2 месяца по сравнению с 17,4 месяца в группе стандартной терапии (относительный риск 1,06, 95% доверительный интервал: 0,95, 1,18). Это соответствует повышению риска смерти на 6% в группе эритропоэтина в комбинации со стандартной терапией. Кроме того, при применении эпоэтина альфа у значительно большего количества пациентов возникли тромботические сосудистые осложнения (2,8% по сравнению с 1,4%, согласно оценке Комитета по подтверждению клинических результатов). В группе эритропоэтина в комбинации со стандартной терапией значительно меньшему количеству пациентов было проведено переливание эритроцитов (5,8% по сравнению с 11,4%). В окончательном анализе было сообщено о 1635 летальных исходах. Медиана общей выживаемости в группе эритропоэтина в комбинации со стандартной терапией составила 17,8 месяца в сравнении с 18 месяцами в группе стандартной терапии (отношение рисков 1,07, 95% ДИ: 0,97, 1,18). Медиана времени до прогрессирования, по оценке прогрессирования заболевания исследователем, в группе эритропоэтина в комбинации со стандартной терапией составила 7,5 месяца в сравнении с 7,5 месяца в группе стандартной терапии (отношение рисков 1,099, 95% ДИ: 0,998, 1,12). Медиана времени до прогрессирования, по оценке прогрессирования заболевания Независимым наблюдательным комитетом, в группе эритропоэтина в комбинации со стандартной терапией составила 8 месяцев в сравнении с 8,3 месяца в группе стандартной терапии (отношение рисков 1,033, 95% ДИ: 0,924, 1,156).
Результаты отдельных исследований без соблюдения рекомендованных критериев (целевая концентрация гемоглобина выше 12 г/дл и/или отсутствие химиотерапии) вызывают сомнения (см. раздел «Меры предосторожности»). Однако, в целом статистические данные, включая результаты мета-анализов и клинический опыт контролируемых исследований препаратов, стимулирующих эритропоэз, всё ещё указывают на благоприятное соотношение потенциального риска и пользы применения препаратов, стимулирующих эритропоэз для пациентов с анемией, вызванной химиотерапией, при соблюдении указаний по назначению и применению препарата, описанных в данной инструкции.
Фармакокинетика
Абсорбция
Содержание в сыворотке крови при подкожном введении значительно ниже и достигает максимального значения после 12-18 часов. Обнаруженное в сыворотке содержание эритропоэтина составляет примерно 20% от значения, полученного при внутривенном введении. Накопительный эффект не прослеживается, т. е. концентрация эритропоэтина в сыворотке крови не изменяется в зависимости от того, была ли она измерена спустя 24 часа после первой или спустя 24 часа после последней инъекции. Зависимость концентрации эритропоэтина от времени спустя одну и четыре недели после многократного введения в дозе 600 МЕ/кг у здоровых участников исследования аналогична.
Распределение
Отсутствуют данные о том, может ли рекомбинантный человеческий эритропоэтин проникать через плацентарный барьер или в грудное молоко, однако через гематоэнцефалический барьер это вещество не проникает.
Метаболизм
Не применимо
Выведение
Период полувыведения эритропоэтина составляет около 4 часов при внутривенном введении в дозе 50-100 МЕ/кг у здоровых пациентов и 5 часов при внутривенном введении в дозе 50, 100 и 150 МЕ/кг у пациентов с заболеваниями почек. Для определения фармакокинетических параметров у пациентов со злокачественными новообразованиями образцы крови были отобраны в течение не менее 4 дней. Измеренный таким образом период полувыведения составил от 20,1 до 33,0 часов при внутривенном введении эпоэтина альфа в дозе 667 и 1500 МЕ/кг.
Период полувыведения при подкожном введении составляет около 24 часов, средний период полувыведения составил 19,4 ± 8,1 часов при многократном введении 150 МЕ/кг 3 раза в неделю у здоровых пациентов.
Биодоступность эпоэтина альфа при подкожном введении дозы 120 МЕ/кг намного ниже, чем при внутривенном введении, и составляет около 20%.
Доклинические данные
Токсичность повторной дозы: в исследованиях токсичности с многократным применением на собаках и крысах, но не на обезьянах, терапия с применением эпоэтина альфа ассоциировалась с субклиническим фиброзом костного мозга. Фиброз костного мозга является известным осложнением хронической почечной недостаточности у человека и может быть обусловлен вторичным гиперпаратиреозом или другими неизвестными факторами. В исследовании с участием пациентов на гемодиализе, получавших эпоэтин альфа в течение трёх лет, заболеваемость фиброзом костного мозга по сравнению с контрольной группой пациентов на гемодиализе, не получавших эпоэтин альфа, не была повышена.
Канцерогенность: продолжительные исследования канцерогенности не проводились. В литературе имеются противоречивые сообщения относительно влияния эритропоэтина на пролиферацию опухолевых клеток. Эти данные основаны на результатах лабораторных исследований клеток человеческих тканей. Клиническая значимость этих результатов в данное время не выяснена.
Мутагенность: эпоэтин альфа не вызывает изменений при проведении теста на мутагенность (тест Эймса) и микроядерного теста.
Репродуктивная токсичность: см. раздел «Применение при беременности и лактации /лактация».
Анемия при хронической почечной недостаточности
Хроническая анемия с клиническими проявлениями, требующая переливания крови, при тяжелой стадии хронической почечной недостаточности (пациенты, как еще не находящиеся па гемодиализе, так и на гемодиализе).
Пациенты со злокачественными новообразованиями
Терапия анемии с клиническими проявлениями и сокращение необходимости переливания крови у взрослых пациентов со злокачественными новообразованиями и уровнем гемоглобина <10,5 г/дл, у которых планируется химиотерапия сроком не менее 2 месяцев.
В клинических исследованиях во время химиотерапии, не содержащей препараты платины, введение препарата Эпрекс® начиналось, как правило, после 2-3 циклов химиотерапии (см. раздел «Фармакодинамика/Механизм действия»).
Предоперационная подготовка для предотвращения переливания донорской крови
Стимуляция эритропоэза перед масштабным ортопедическим вмешательством для сокращения аллогенного переливания крови и коррекции послеоперационной анемии у взрослых пациентов без дефицита железа. Терапию препаратом Эпрекс® следует проводить только у пациентов с анемией средней степени тяжести (уровень гемоглобина 10-13 г/дл) и ожидаемой кровопотерей объёмом 900-1800 мл.
Предоперационная подготовка с забором аутологичной крови
Стимуляция эритропоэза для увеличения объёма забора аутологичной крови и меньшего снижения уровня гемоглобина перед проведением масштабных элективных операций у взрослых пациентов, у которых в соответствии с ожиданиями не может быть отобрано достаточное количество единиц аутологичной крови.
Терапию препаратом Эпрекс® следует проводить только у пациентов без дефицита железа с анемией средней степени тяжести (уровень гемоглобина 10-13 г/дл), если меры по получению донорской крови недоступны или недостаточны и запланированное оперативное вмешательство требует больших объёмов крови для переливания (не менее 4 единиц для женщин; не менее 5 единиц для мужчин).
Примеры применения: Низкий уровень гемоглобина, потребность в аутологичной крови ≥5 единиц, короткие сроки предоперационной подготовки.
Повышенная чувствительность к активному веществу или одному из вспомогательных веществ.
Запрещено вводить Эпрекс® или другой препарат эритропоэтина пациентам, у которых в результате терапии препаратом Эпрекс® или другого эритропоэтина развилась эритробластопения (чистая красноклеточная аплазия) (см. раздел «Меры предосторожности»).
Неконтролируемая гипертензия.
При тяжёлой форме острой анемии, требующей незамедлительной коррекции, препарат Эпрекс® не заменяет экстренное переливание крови.
Пациенты, которые не могут получить адекватное профилактическое лечение тромбоза в связи с хирургическими вмешательствами.
Пациентам, которым предстоит объемная плановая хирургическая операция, не участвующим в программе забора аутологичной крови, запрещено вводить Эпрекс®, если они страдают тяжёлой формой ишемической болезни сердца, окклюзией периферических артерий, окклюзионным поражением сонных артерий или цереброваскулярной болезнью, а также после недавнего инфаркта миокарда или нарушения мозгового кровообращения (инсульта).
Пациенты с тромбоэмболическими заболеваниями в анамнезе.
Все противопоказания, связанные с программами забора аутологичной крови, необходимо также учитывать у пациентов, которые получают Эпрекс® в рамках забора аутологичной крови.
Злокачественные миелоидные заболевания.
Обычная дозировка
1. Хроническая почечная недостаточность
Пациентам с хронической почечной недостаточностью и функционирующим внутривенным доступом (пациентам на гемодиализе) препарат следует вводить внутривенно. Введение должно длиться 1-5 минут (см. раздел «Меры предосторожности»). В случае, если установка внутривенного доступа затруднена (пациенты без потребности в гемодиализе или пациенты на перитонеальном гемодиализе), препарат Эпрекс® можно вводить подкожно.
Целевая концентрация гемоглобина составляет от 10 до 12 г/дл (6,2-7,5 ммоль/л).
Начальная терапия: в начале лечения рекомендуется следующая дозировка: 50МЕ/кг массы тела 3 раза в неделю.
Дальнейшее лечение зависит от ответа на терапию, в среднем повышение уровня гемоглобина составляет не более 2 г/дл/месяц (1,25 ммоль/л/месяц). При необходимости следует повышать дозу каждые 4 недели на 25 МЕ/кг массы тела, т. е. по истечении 4 недель начальной терапии следует повысить дозу до 75 МЕ/кг массы тела 3 раза в неделю до достижения оптимального уровня гемоглобина от 10 до 12 г/дл (6,2-7,5 ммоль/л; гематокрита 0,30-0,35).
Если при введении 50 МЕ/кг массы тела 3 раза в неделю повышение уровня гемоглобина составляет более 2.г/дл/месяц (1,25 ммоль/л/месяц), следует проводить коррекцию дозы путём уменьшения частоты введения на одну инъекцию в неделю.
Лечащий врач определяет оптимальный уровень гемоглобина; по полученным ранее результатам, для указанной терапии он составляет 10-12 г/дл (6,2-7,5 ммоль/л; уровень гематокрита 0,30-0,35).
При поддерживающей терапии у пациентов с хронической почечной недостаточностью не следует превышать верхний предел целевой концентрации гемоглобина (см. раздел «Меры предосторожности»).
Продолжительная терапия: Согласно имеющимся данным пациентам с начальным уровнем гемоглобина ниже 6 г/дл (3,7 ммоль/л) необходимы более высокие поддерживающие дозы, чем пациентам, у которых начальный уровень гемоглобина превышает 8 г/дл (5,0 ммоль/л).
Для пациентов с начальным уровнем гемоглобина выше 8 г/дл (5,0 ммоль/л) еженедельная поддерживающая доза, как правило, составляет 100 МЕ/кг массы тела или немного больше. Необходимо контролировать уровень железа до начала и во время терапии (см. раздел «Меры предосторожности»). При одновременном применении препаратов железа в случае необходимости следует уменьшить дозу препарата Эпрекс®, чтобы предотвратить слишком быстрое и слишком сильное повышение уровня гемоглобина.
Взрослые пациенты с хронической почечной недостаточностью:
Необходимо регулярное обследование пациентов, чтобы обеспечить применение минимальной допустимой эффективной дозы препарата Эпрекс®, адекватный контроль симптомов анемии и поддержание уровня гемоглобина не вьпле 12 г/дл (7,5 ммоль/л). У пациентов с хронической почечной недостаточностью дозу препарата Эпрекс® следует повышать с осторожностью. У пациентов со слабым ответом на препарат Эпрекс® в отношении уровня гемоглобина, следует уточнить причины слабого ответа (см. разделы «Меры предосторожности» и «Фармакодинамика/Механизм действия»).
Взрослые пациенты с хронической почечной недостаточностью и потребностью в гемодиализе:
Для поддержания оптимального уровня гемоглобина 10-12 г/дл (6,2-7,5 ммоль/л; уровень гематокрита 0,30-0,35) достаточно, как правило, продолжения терапии с еженедельной поддерживающей дозой, составляющей в среднем 100-300 МЕ/кг массы тела, поделённой на 2 или 3 разовые дозы.
Взрослые пациенты с хронической почечной недостаточностью без потребности в гемодиализе:
В ходе продолжительной терапии препарат Эпрекс® можно применять 3 раза в неделю, или, при подкожном введении, один раз в неделю, или один раз в 2 недели у пациентов со стабильным уровнем гемоглобина при более коротких промежутках между дозами. Следует провести адекватную коррекцию дозы и частоты применения для поддержания желаемого уровня гемоглобина 10-12 г/дл (6,2-7,5 ммоль/л). При увеличении промежутков между инъекциями препарата может потребоваться повышение дозы.
У пациентов, у которых после увеличения промежутков между инъекциями препарата и адекватной коррекции дозы, не достигнута стабильная концентрация гемоглобина, следует сократить промежутки между инъекциями препарата Эпрекс® (см. раздел «Клиническая эффективность и безопасность»). Необходим регулярный контроль уровня гемоглобина.
Не следует превышать максимальную дозу, составляющую 200 МЕ/кг массы тела 3 раза в неделю, 240 МЕ/кг (не более 20 000 ME) один раз в неделю или 480 МЕ/кг (не более 40 000 ME) один раз в 2 недели.
2. Пациенты со злокачественными новообразованиями
При решении о необходимости терапии препаратом Эпрекс® следует учитывать общее состояние пациента, т. е. основное заболевание, вид опухоли и состояние сердечно-сосудистой системы.
Раствор для инъекций следует вводить подкожно.
Эпоэтин альфа можно применять раз в неделю или три раза в неделю.
Эпоэтин альфа следует применять у пациентов с анемией (т.е. с уровнем гемоглобина ≤10,5 г/дл [6,5 ммоль/л]).
Целевая концентрация гемоглобина составляет для мужчин и женщин от 10 до 12 г/дл (6,2-7,5 ммоль/л) и ее не следует превышать.
После завершения химиотерапии следует продолжать применение препарата Эпрекс® в течение одного месяца.
Применение три раза в неделю
Начальная терапия: доза составляет 150 МЕ/кг массы тела подкожно три раза в неделю.
Если по истечении 4 недель терапии повышение уровня гемоглобина составило не менее 1 г/дл (0,62 ммоль/л) или количество ретикулоцитов увеличилось на ≥40 000 клеток/мкл относительно начального значения, дозировку в 150 МЕ/кг массы тела следует оставить без изменений.
Если по истечении 4 недель терапии повышение уровня гемоглобина составило менее 1 г/дл (0,62 ммоль/л), и количество ретикулоцитов увеличилось на <40 000 клеток/мкл относительно начального значения, то ответ на препарат Эпрекс® следует расценивать как низкий, и терапию следует прекратить.
Применение один раз в неделю
Начальная терапия: Дозировка составляет 450 МЕ/кг массы тела подкожно один раз в неделю.
| Масса тела (кг) | Общее количество единиц препарата (ME) |
Предзаполненные
шприцы Эпрекс® 1 раз в неделю (1000 ME) |
| 50 | 22 500 | 1 х 20,1 х 2 |
| 55 | 24 750 | 1 х 20,1 х 5 |
| 60 | 27 000 | 1 х 20,1 х 6 |
| 65 | 29 250 | 1 х 20,1 х 8 |
| 70 | 31 500 | 1 х 30 |
| 75 | 33 750 | 1 х 30 |
| 80 | 36 000 | 1 х 40 |
| 85 | 38 250 | 1 х 40 |
| 90 | 40 500 | 1 х 40 |
| 95 | 42 750 | 1 х 40,1 х 2 |
Если по истечении 4 недель терапии повышение уровня гемоглобина составило не менее 1 г/дл (0,62 ммоль/л) или количество ретикулоцитов увеличилось на ≥40 000 клеток/мкл относительно начального значения, дозировку в 450 МЕ/кг массы тела следует оставить без изменений.
Если по истечении 4 недель терапии повышение уровня гемоглобина составило менее 1 г/дл (0,62 ммоль/л) и количество ретикулоцитов увеличилось на <40 000 клеток/мкл относительно начального значения, то ответ на препарат Эпрекс® следует расценивать как низкий, и терапию следует прекратить.
Коррекция дозы у пациентов со злокачественными новообразованиями
Следует избегать повышения уровня гемоглобина >1 г/дл (>0,62 ммоль/л) в течение двух недель, повышения уровня гемоглобина >2 г/дл (>1,25 ммоль/л) в течение месяца или уровня гемоглобина >12 г/дл (>7,5 ммоль/л). При повышении уровня гемоглобина >1 г/дл (>0,62 ммоль/л) в течение двух недель, повышении уровня гемоглобина >2 г/дл (>1,25 ммоль/л) в течение месяца, или при уровне гемоглобина, близком к 12 г/дл (7,5 ммоль/л) следует уменьшить дозу препарата Эпрекс® на 25-50% в зависимости от повышения уровня гемоглобина. Если уровень гемоглобина превысил 12 г/дл (7,5 ммоль/л), терапию следует прекратить до тех пор, пока уровень гемоглобина не опустится ниже 12 г/дл (7,5 ммоль/л). При возобновлении терапии дозу необходимо сократить на 25%.
3. Предоперационная подготовка для предотвращения переливания донорской крови
Эпрекс® следует вводить подкожно.
Рекомендуемая доза составляет 600 МЕ/кг массы тела один раз в неделю, в сумме 4 введения: начиная за 3 недели до оперативного вмешательства (день -21, -14, и -7) и в день операции (день 0).
Если уровень гемоглобина ≥15 г/дл, не следует продолжать применение препарата Эпрекс®.
4. Предоперационная подготовка с забором аутологичной крови
Эпрекс® следует вводить внутривенно после каждого забора аутологичной крови.
Начальная терапия: Последующие рекомендации относятся к пациентам, которые сдают кровь 2 раза в неделю в течение 3 недель до плановой операции. Как показывает практика, эффективная доза для повьппения эритропоэза у таких пациентов колеблется от 150 до 300 МЕ/кг внутривенно 2 раза в неделю в течение 3 недель. Доза в 600 МЕ/кг внутривенно 2 раза в неделю в течение 3 недель рекомендуется пациентам, которым необходима максимальная стимуляция эритропоэза, например:
Необходим еженедельный мониторинг уровня гемоглобина.
Продолжительная терапия: Продолжительная терапия не предусмотрена.
Особые указания по введению
Дети и подростки
Безопасность и эффективность препарата у детей и подростков не изучались.
Способ введения
Как и другие лекарственные препараты для парентерального введения, раствор для инъекций перед применением необходимо проверить на наличие взвешенных частиц и окрашивания.
Не трясти; это может привести к денатурации гликопротеина и его инактивации.
Каждый шприц Препарат Эпрекс® предназначен только для однократного введения; из каждого шприца может быть введена только одна доза препарата Эпрекс®.
a) Внутривенное введение
При внутривенном введении препарата Эпрекс® в зависимости от общей дозы введение необходимо производить в течение 1-5 минут. Пациентам на гемодиализе возможно болюсное введение разовой дозы во время гемодиализа через подходящий венозный порт гемодиализной системы. В качестве альтернативы введение можно выполнить по окончании гемодиализа в артериовенозную фистулу. Затем следует ввести 10 мл изотонического солевого раствора (NaCl 0,9%) для промывки системы, чтобы обеспечить полное попадание эпоэтина альфа в систему кровообращения.
Пациентам с характерными для заболевания гриппом симптомами и болями в костях после применения эритропоэтина рекомендуется выполнять введение в течение 5 минут.
Эпрекс® не предназначен для применения в виде внутривенной инфузии, а также для одновременного введения и смешивания с другими веществами или растворами.
b) Подкожное введение
Подкожное введение необходимо также производить медленно. При этом по возможности не следует вводить более 1 мл раствора для инъекции в одно место, так как у чувствительных пациентов это может вызвать локальную болевую реакцию. Большие объёмы следует вводить в несколько разных мест или, не вынимая полностью инъекционную иглу из-под кожи, вводить части препарата в разных направлениях.
Рекомендуется вводить препарат в бедро или переднюю часть брюшной стенки.
Если пациент будет делать подкожные инъекции самостоятельно, он должен получить подробную консультацию и точную инструкцию по самостоятельному введению препарата. Необходим регулярный контроль со стороны врача.
Первая инъекция препарата Эпрекс® должна выполняться в условиях медицинского учреждения с последующим временем наблюдения не менее 4 часов.
При прекращении терапии препаратом Эпрекс® возможно уменьшение концентрации гемоглобина не менее чем на 0,5 г/дл в неделю.
Эффективность и безопасность препарата для детей и подростков не была исследована.
Для обеспечения прослеживаемости биотехнологических лекарственных препаратов рекомендуется документировать торговое наименование и номер серии при каждом применении.
Беременность
В исследованиях на животных с применением почти двадцатикратной от рекомендуемой для применения у человека недельной дозы эпоэтин альфа приводил к уменьшению массы тела эмбрионов, замедлению окостенения и увеличению общей гибели плодов. Считается, что это связано с уменьшением набора массы тела материнских особей.
Достаточного количества данных о применении во время беременности нет. По этой причине препарат следует применять только в случае явной необходимости.
Лактация
Эритропоэтин присутствует в грудном молоке. Однако неизвестно, проникает ли эпоэтин альфа в грудное молоко, поэтому во время применения препарата следует прекратить кормление.
Не рекомендуется применять препарат Эпрекс® во время беременности и лактации, если пациентка участвует в программе сбора аутологичной крови.
Суммарный профиль безопасности
Наиболее распространенной нежелательной реакцией во время терапии препаратом Эпрекс® было повышение артериального давления в зависимости от дозы или обострение имеющейся гипертонии. Необходимо контролировать артериальное давление, прежде всего в начале терапии. Наиболее распространенными нежелательными реакциями, о которых сообщалось во время клинических исследований, были: диарея, тошнота, рвота, повышенная температура и головные боли. Возможно развитие гриппоподобного заболевания, в особенности в начале терапии.
У пациентов, проходящих терапию с применением препаратов, стимулирующих эритропоэз, была отмечена повышенная частота тромбоэмболических событий (см. раздел «Меры предосторожности»).
Об аллергических реакциях, включая случаи кожных высыпаний (в том числе уртикарии), анафилактических реакциях и ангионевротических отёках сообщений не поступало.
Гипертонические кризы с энцефалопатией и судорожными припадками, требующие незамедлительного врачебного вмешательства и оказания интенсивной медицинской помощи, также возникали во время терапии с применением эпоэтина альфа у пациентов, ранее имевших нормальное или пониженное артериальное давление. Рекомендуется своевременно выявлять случаи внезапных колющих мигренеподобных головных болей.
Клинические исследования
Из 3559 пациентов, принимавших участие в 27 рандомизированных двойных слепых плацебо-контролируемых исследованиях или контролируемых исследованиях со стандартным лечением, глобальный профиль безопасности препарата Эпрекс® был изучен у 2136 пациентов с анемией. При составлении профиля безопасности были учтены данные 228 пациентов с хронической почечной недостаточностью, получавших терапию препаратом Эпрекс®, из 4 клинических исследований (2 исследования с догемодиализпыми пациентами и 2 исследования с гемодиализными пациентами), 1404 пациентов со злокачественными новообразованиями из 16 исследований по анемии, вызванной химиотерапией, 144 пациентов из 4 исследований по ВИЧ-инфекции, 147 пациентов из 2 исследований программы забора аутологичной крови и 213 пациентов из 1 предоперационного исследования. Нежелательные реакции, описанные в этих исследованиях у ≥0,1% пациентов, получающих Эпрекс®, перечислены ниже по классам систем органов и частоте возникновения.
Нежелательные реакции, отмеченные у ≥1% пациентов в клинических исследованиях эпоэтина альфа:
| Хроническая почечная недостаточность | Онкологические заболевания | Программа забора аутологической крови | Хирургия | |||||||
| Класс систем органов | Догемодиализные пациенты | Гемодиализные пациенты | ||||||||
| ЭПО | Плацебо | ЭПО | Плацебо | ЭПО | Не СЭП | ЭПО | Не СЭП | ЭПО | Плацебо | |
| N=131 | N=79 | N=97 | N=46 | N=1404 | N=930 | N=147 | N=112 | N=213 | N=103 | |
| n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | |
| Нарушения метаболизма и питания | ||||||||||
| Гиперкалиемия | 3 (2) | 3 (4) | 10 (10) | 2 (4) | 2 (<1) | 2 (<1) | НС | НС | НС | 1 (1) |
| Нарушения со стороны нервной системы | ||||||||||
| Судорожные припадки | 1 (1) | 2 (3) | 2 (2) | NB | 12 (1) | 4 (<1) | НС | НС | НС | НС |
| Головные боли | 22 (17) | 14 (18) | 33 (34) | 20 (43) | 98 (7) | 50 (5) | 17 (12) | 16 (14) | 25 (12) | 9 (9) |
| Нарушения со стороны сосудов | ||||||||||
| Эмболия и тромбозb | 2 (2) | НС | 15 (15) | 2 (4) | 76 (5) | 33 (4) | 6 (4) | 3 (3) | 18 (8) | 6 (6) |
| Глубокий тромбоз вен | НС | НС | НС | НС | 24 (2) | 6 (1) | 2 (1) | 2 (2) | 10 (5) | 3 (3) |
| Тромбоз | НС | НС | 4 (4) | 1 (2) | 18 (1) | 6 (1) | 2 (1) | НС | 3 (1) | НС |
| Гипертонияс | 35 (27) | 20 (25) | 32 (33) | 5 (11) | 43 (3) | 24 (3) | НС | 2 (2) | 23 (11) | 9 (9) |
| Нарушения со стороны дыхательной системы, органов грудной клетки и средостения | ||||||||||
| Кашель | 5 (4) | 1 (1) | 9 (9) | 8 (17) | 98 (7) | 66 (7) | 2 (1) | 2 (2) | 10 (5) | НС |
| Гиперемия дыхательных путей | НС | НС | 9 (9) | 2 (4) | НС | НС | НС | НС | НС | НС |
| Желудочно-кишечные нарушения | ||||||||||
| Тошнота | 14 (11) | 10 (13) | 23 (14) | 13 (28) | 265 (19) | 193 (21) | 26 (18) | 11 (10) | 96 (45) | 45 (45) |
| Диарея | 16 (12) | 8 (10) | 7 (7) | 4 (9) | 168 (12) | 102 (11) | 5 (3) | 7 (6) | 18 (8) | 12 (12) |
| Рвота | 12 (9) | 6 (8) | 9 (9) | 8 (17) | 173 (12) | 134 (14) | 7 (5) | 1 (1) | 36 (17) | 14 (14) |
| Нарушения со стороны кожи и подкожных тканей | ||||||||||
| Кожное высыпаниеа | 8 (6) | 6 (8) | 11 (11) | 2 (4) | 93 (7) | 47 (5) | 3 (2) | 2 (2) | 8 (4) | 2 (2) |
| Нарушения со стороны мышечной, скелетной и соединительной ткани | ||||||||||
| Артралгия | 16 (12) | 6 (8) | 23 (24) | 3 (7) | 45 (3) | 43 (5) | 3 (2) | 3 (3) | 5 (2) | 3 (3) |
| Боли в костях | 1 (1) | НС | 6 (6) | 1 (2) | 47 (3) | 26 (3) | НС | 1 (1) | 1 (<1) | НС |
| Миалгия | 3 (2) | 1 (1) | 6 (6) | НС | 46 (3) | 25 (3) | 2 (1) | 3 (3) | 2 (1) | НС |
| Боли в конечностях | 7 (5) | 7 (9) | 15 (5) | 2 (4) | 37 (3) | 19 (2) | 6 (4) | 2 (2) | 7 (3) | 4 (4) |
| Общие нарушения и реакции в месте введения | ||||||||||
| Озноб | 6 (5) | 2 (3) | 10 (10) | 3 (7) | 33 (2) | 32 (3) | 8 (5) | 4 (4) | 12 (6) | 1 (1) |
| Гриппоподобные заболевание | 1 (1) | НС | 9 (9) | 6 (13) | 23 (2) | 10 (1) | 4 (3) | 1 (1) | 1 (<1) | НС |
| Реакции в месте введения | 14 (11) | 16 (29) | 1 (1) | НС | 42 (3) | 31 (3) | НС | 1 (1) | 39 (18) | 19 (18) |
| Повышенная температура | 4 (3) | 4 (5) | 9 (9) | 6 (13) | 189 (13) | 139 (14) | 7 (5) | 3 (3) | 37 (17) | 27 (16) |
| Периферический отёк | 9 (7) | 10 (13) | НС | НС | 72 (5) | 34 (4) | 2 (1) | 2 (2) | 14 (7) | 4 (4) |
ЭПО: эритропоэтин альфа
СЭП: стимулирующие эритропоэз препараты
НС: не сообщалось
а кожные высыпания, включая уртикарную
сьть и ангионевротический отёк
b включая такие
артериальные и венозные нарушения со смертельным исходом и без него, как
тромбозы глубоких вен, лёгочные эмболии, тромбозы сосудов сетчатки, тромбозы
артерии (в том числе инфаркт миокарда), цереброваскулярные осложнения (например
инсульт, в том числе инфаркт мозга и кровоизлияние в мозг), транзиторные
ишемические атаки, тромбозы шунтирующих систем (в том числе систем для
гемодиализа) и тромбозы артериовенозного шунта, аневризмы.
с гипертония, включая гипертонические
кризы
Нежелательные реакции в период пострегистрационного наблюдения
Ниже указаны нежелательные реакции, наблюдавшиеся после поступления препарата Эпрекс® в продажу. Информация о нежелательных реакциях изложена в соответствии с системно-органной классификацией и частотой встречаемости. Категории частоты: очень часто (≥1/10), часто (≥1/100, но <1/10), нечасто (≥1/1000, но <1/100), редко (≥1/10 000, но <1/1000), очень редко (<1/10 000), частота неизвестна (исходя из имеющихся данных, частоту возникновения определить невозможно).
Очень редко (<1/10 000 случаев в год на пациента) регистрировались сообщения о эритробластопении (чистой красноклеточной аплазии), вызванной антителами к эритропоэтину спустя несколько месяцев или лет после терапии препаратом Эпрекс®.
Нежелательные реакции, отмечавшиеся после поступления препарата Эпрекс® в продажу (частота возникновения определена на основе частоты спонтанных сообщений):
Нарушения со стороны крови и лимфатической системы
Очень редко: эритробластонения (чистая красноклеточная аплазия), вызванная антителами к эритропоэтину, тромбоцитемия.
Нарушения со стороны кожи и подкожных тканей
Очень редко: тяжелые кожные реакции, включая мультиформную эритему, синдром Стивенса-Джонсона (ССД)/токсический эпидермальный некролиз (ТЭН).
* Очень редко (<1/10 000 случаев на пациента в год) сообщалось об эритробластопении (чистая эритроцитарная аплазия) через месяцы или годы после лечения Эпрексом.
Сообщения
о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых
нежелательных реакциях после регистрации лекарственного препарата с целью
обеспечения непрерывного мониторинга соотношения «польза-риск» лекарственного
препарата. Медицинским работникам рекомендуется сообщать о подозреваемых
нежелательных реакциях лекарственного препарата через национальные системы
сообщения о нежелательных реакциях государств-членов Евразийского
экономического союза.
Республика Беларусь
220037, Минск, Товарищеский пер., 2а
УП «Центр экспертиз и испытании в
здравоохранении»
Телефон отдела
фармаконадзора: +375 (17) 242-00-29; факс: +375 (17) 242-00-29.
Ответ на препарат Эпрекс® зависит от дозы и индивидуальных особенностей. После однократного применения избыточной дозы побочные эффекты маловероятны, но повторяющаяся передозировка может привести к полиглобулии и гипертензии. Соответствующие меры указаны в разделе «Меры предосторожности».
Данные о влиянии терапии препаратом Эпрекс® на метаболизм других лекарственных средств отсутствуют. Лекарственные средства, снижающие эритропоэз, могут ослаблять ответ на препарат Эпрекс®.
Стимулирующее действие препарата Эпрекс® на эритропоэз может быть усилено при одновременном приёме железосодержащих препаратов в случае дефицита железа.
У пациентов с интоксикацией алюминием или инфекцией действие препарата Эпрекс® может быть замедленно или ослаблено.
Вызванное препаратом Эпрекс® повышение концентрации гемоглобина может усиливать действие средств против стенокардии.
Может быть ослаблено действие принимаемых одновременно антигипертензивных средств.
Имеются данные о влиянии на действие препарата при одновременном приёме ингибиторов АИФ (ангиотензинпревращающего фермента).
При одновременной противосудорожной терапии может повыситься склонность к судорогам.
Так как циклоспорин А связывается эритроцитами, возможно взаимодействие с ним препарата Эпрекс®. Поэтому при одновременном применении циклоспорина А и препарата Эпрекс® следует измерять концентрацию циклоспорина А в крови. При необходимости следует корректировать дозу циклоспорина А.
У пациентов с метастатическим раком молочной железы одновременное применение эпоэтина альфа подкожно в дозировке 40000 МЕ/мл и трастузумаба в дозировке 6 мг/кг не влияло на фармакокинетику трастузумаба.
Гипертензия
У всех пациентов, получающих препарат Эпрекс®, следует регулярно контролировать артериальное давление и при необходимости проводить корригирующую терапию.
При повышенном артериальном давлении, по поводу которого терапия не проводилась, или она была неадекватной, или при наличии плохо контролируемой артериальной гипертензии препарат Эпрекс® следует применять с осторожностью. Возможно, потребуется дополнительная или усиленная антигипертензивная терапия. Если артериальное давление невозможно контролировать, терапию препаратом Эпрекс® следует прекратить.
Во время терапии препаратом Эпрекс® у пациентов, ранее имевших нормальное или пониженное артериальное давление, были отмечены гипертонические кризы с энцефалопатией и судорожными припадками, требовавшие незамедлительного врачебного вмешательства и оказания интенсивной терапии. Рекомендуется обращать особое внимание на случаи внезапных колющих мигренеподобных головных болей, которые могут являться симптомом тревоги (см. раздел «Побочное действие»).
Эритробластопения (чистая красноклеточная аплазия)
На фоне применения препарата Эпрекс® или препаратов эритропоэтина отмечены случаи эритробластопении (чистая красноклеточная аплазия).
У пациентов с хронической почечной недостаточностью, которым препарат Эпрекс® вводят подкожно, следует регулярно проводить контроль уменьшения эффективности препарата, которое определяется как отсутствие ответа или снижение ответа на терапию препаратом Эпрекс® у пациентов, ранее демонстрировавших хороший ответ на подобную терапию. Это обнаруживается при продолжающемся снижении уровня гемоглобина несмотря на увеличение дозы препарата Эпрекс®.
У пациентов с внезапным уменьшением эффективности эритропоэтинов, которое проявляется снижением уровня гемоглобина (1-2г/дл в месяц) при повышенной потребности в переливании крови, необходимо измерить уровень ретикулоцитов и провести исследование на наличие других причин слабого ответа на препарат (например, дефицита железа, фолиевой кислоты или витамина В12, интоксикации алюминием, инфекции или воспаления, кровопотери, гемолиза и фиброза костного мозга любого генеза). Если содержание ретикулоцитов снижено (<20 000/мм3), число тромбоцитов и лейкоцитов в норме, не обнаружено других причин уменьшения эффективности препарата, следует измерить уровень антиэритропоэтиновых антител и обсудить необходимость исследования костного мозга с целью диагностики эритробластопении (чистой красноклеточной аплазии).
В случае верификации диагноза эритробластопении (чистой красноклеточной аплазии) необходимо незамедлительно прекратить применение препарата Эпрекс®. В связи с риском перекрёстной реакции не следует начинать терапию с применением других эритропоэтинов. При наличии показаний таким пациентам может быть сделано переливание крови.
Общее
Следует соблюдать осторожность при применении препарата Эпрекс® у пациентов с эпилепсией, эпилептическими припадками в анамнезе или такими заболеваниями, ассоциированными со склонностью к эпилептическим припадкам, как инфекции ЦНС и метастазы в головной мозг.
Следует с осторожностью применять препарат Эпрекс® у пациентов с хроническим нарушением функции печени. Безопасность препарата Эпрекс® у пациентов с нарушением функции печени не была исследована. В связи с замедлением обмена веществ у пациентов с нарушением функции печени под воздействием препарата Эпрекс® может отмечаться усиление эритропоэза.
У пациентов, которым проводится терапия с применением препаратов, стимулирующих эритропоэз, наблюдалась повышенная частота тромботических сосудистых осложнений (см. раздел «Побочное действие»). К этим осложнениям относятся такие венозные и артериальные тромбозы и эмболии (в том числе со смертельным исходом), как тромбоз глубоких вен, лёгочная эмболия, тромбоз сосудов сетчатки и инфаркт миокарда. Кроме того, поступали сообщения о симптомах нарушения мозгового кровообращения (включая ишемический инсульт, кровоизлияние в мозг и транзиторные ишемические атаки). Необходимо провести тщательную оценку соотношения риска тромботических сосудистых осложнений и потенциальной пользы терапии с применением эпоэтина альфа, прежде всего у пациентов с наличием вышеуказанных факторов риска в анамнезе.
У всех пациентов следует проводить регулярный мониторинг концентрации гемоглобина, так как существует потенциально повышенный риск тромбоэмболических осложнений со смертельным исходом, наблюдаемый у пациентов с повышенным уровнем гемоглобина в случае терапии препаратом Эпрекс®.
Безопасность и эффективность терапии эпоэтином альфа у пациентов с доброкачественным гематологическим заболеванием (например, гемолитической анемией, серповидно-клеточной анемией, талассемией) не исследовалась.
Терапия препаратом Эпрекс® может привести к незначительному, зависящему от дозы повышению количества тромбоцитов в пределах нормальных значений, которое регрессирует при дальнейшем лечении. Кроме того, была отмечена тромбоцитемия с превышением нормальных значений. В течение первых 8 недель терапии рекомендуется регулярно контролировать количество тромбоцитов.
Перед началом терапии препаратом Эпрекс® и перед повышением дозы необходимо провести оценку и лечение других причин анемии, например, дефицита витамина В12, фолиевой кислоты или железа, инфекции или воспаления, потери крови, гемолиза и фиброза костного мозга любого генеза. В большинстве случаев уровень ферритина в сыворотке крови снижается одновременно с увеличением гематокрита. Для достижения оптимальной реакции на Эпрекс® следует обеспечить достаточные запасы железа с применением в случае необходимости дополнительных железосодержащих препаратов:
При терапии эпоэтином альфа очень редко наблюдались случаи манифестации порфирии или обострения имеющейся порфирии. Пациентам с установленным диагнозом порфирии использовать эпоэтин альфа следует с осторожностью.
У небольшого числа пациентов при использовании препарата Эпрекс® были отмечены нежелательные явления в виде образований волдырей и эксфолиацией, включая мультиформную эритему, синдром Стивенса-Джонсона (ССД)/токсический эпидермальный некролиз (ТЭН). При развитии тяжелых форм кожных осложнений (например, ССД/ТЭН) следует немедленно прекратить применение препарата Эпрекс®. Следует обращать внимание на наличие проявления со стороны слизистых оболочек (слизистой оболочки полости рта, глаз, гениталий).
Пациенты с хронической почечной недостаточностью
Терапия анемии с клиническим проявлениями у взрослых пациентов с хронической почечной недостаточностью:
Во время применения препарата Эпрекс® необходимо регулярно измерять уровень гемоглобина, пока не будет достигнуто стабильное значение 10-12 г/дл (6,2-7,5 ммоль/л; гематокрит 0,30-0,35). Затем следует периодически контролировать уровень гемоглобина. У пациентов с хронической почечной недостаточностью скорость увеличения уровня гемоглобина должна составлять около 1 г/дл (0,62 ммоль/л) в месяц и не должна превышать 2 г/дл (1,25 ммоль/л) в месяц с целью минимизации риска повышения артериального давления.
У пациентов с хронической почечной недостаточностью во время поддерживающей терапии не следует превышать верхнюю границу нормы концентрации гемоглобина 10- 12 г/дл (рекомендуемый диапазон уровня гемоглобина см. в разделе «Способ применения и дозы»). Целевая концентрация гемоглобина 13 г/дл или выше может привести к повьппенному риску сердечно-сосудистых событий, в т.ч. со смертельным исходом. Следует с осторожностью повышать дозу препарата Эпрекс® у пациентов с хронической почечной недостаточностью, так как высокие суммарные дозы препарата могут быть ассоциированы с повышенным риском смерти, тяжёлых сердечно-сосудистых и цереброваскулярных осложнений. У пациентов со слабым ответом на терапию препаратом Эпрекс® в отношении уровня гемоглобина следует выяснить причины слабого ответа (см. разделы «Фармакодинамика/Механизм действия» и «Меры предосторожности»).
У пациентов с хронической почечной недостаточностью и недостаточным ответом на препараты, стимулирующие эритропоэз, в отношении уровня гемоглобина может наблюдаться повышенный риск сердечно-сосудистых осложнений и смерти в сравнении с другими пациентами.
В отдельных случаях поступали сообщения о возникновении гипергликемии, однако причинно-следственной связи не было установлено. У пациентов с хронической почечной недостаточностью следует контролировать уровень электролитов в плазме крови. При повышенном или растущем содержании калия следует, наряду с соответствующим лечением гиперкалиемии, обсудить необходимость прекращения терапии препаратом Эпрекс® до восстановления нормального содержания калия.
У пациентов на гемодиализе отмечались случаи тромбоза шунтирующей системы, прежде всего у пациентов со склонностью к гипотонии или с наличием осложнений, связанных с наличием артериовенозной фистулой (например, стенозами, аневризмами и т. д.). У таких пациентов рекомендован заблаговременный контролъ состояния шунтирующей системы, а также профилактическое лечение тромбоза с применением ацетилсалициловой кислоты.
В связи с повышением гематокрита при терапии препаратом Эпрекс® часто бывает необходимо увеличить дозу гепарина во время гемодиализа. При неадекватной гепаринизации возможна закупорка гемодиализной системы.
У некоторых пациенток с хронической почечной недостаточностью после терапии с применением эпоэтина альфа снова начиналась менструация. Следует обсудить возможность наступления беременности и оценить необходимость применения противозачаточных средств.
Терапия анемии с клиническим проявлениями у взрослых пациентов с хронической почечной недостаточностью без потребности в гемодиализе:
У некоторых пациентов с увеличенными промежутками между введениями препарата (реже, чем один раз в неделю) не может быть достигнут достаточный уровень гемоглобина, поэтому необходимо повысить дозу препарата Эпрекс®. Пациентам, у которых после увеличения интервалов времени между инъекциями препарата и адекватной коррекции дозы концентрация гемоглобина нестабильна, следует вводить препарат Эпрекс® с более короткими промежутками (см. раздел «Клиническая эффективность и безопасность»). Необходимо регулярно контролировать уровень гемоглобина.
В соответствии с новыми данными, в результате терапии анемии препаратом Эпрекс® у пациентов с почечной недостаточностью без потребности в гемодиализе скорость развития почечной недостаточности не увеличивается.
Пациенты со злокачественными новообразованиями
У пациентов со злокачественными новообразованиями необходимо регулярно измерять уровень гемоглобина, пока не будет достигнуто стабильное значение, а затем периодически проводить контроль.
Воздействие на рост опухоли
Препараты, стимулирующие эритропоэз, являются факторами роста, которые в первую очередь стимулируют образование красных кровяных телец. Рецепторы эритропоэтина могут формироваться на поверхности различных опухолевых клеток. Существуют опасения, что препараты, стимулирующие эритропоэз, могут стимулировать рост опухоли. В ходе контролируемых клинических исследований препарата Эпрекс® и других препаратов, стимулирующих эритропоэз, было установлено:
Перед применением препаратов эпоэтина у пациентов со злокачественными новообразованиями с анемией с клиническими проявлениями и пациентов, проходящих миелосупрессивную химиотерапию, необходимо по согласованию с пациентом провести тщательную индивидуальную оценку соотношения потенциального риска и пользы, в особенности учитывая прогноз заболевания. Препараты эпоэтина не следует использовать при проведении радикальных методов лечения.
У пациентов со злокачественными новообразованиями, получающих химиотерапию, при оценке эффективности терапии следует учитывать двух-/трёхнедельный срок между введением эпоэтина и ответом на эритропоэтин (это относится в первую очередь к пациентам с риском необходимости переливания крови).
Предоперационная подготовка для предотвращения переливания донорской крови
Меры по предотвращению переливания донорской крови должны проводиться всегда при проведении оперативных вмешательств.
Пациентам, которым предстоит плановая ортопедическая операция, необходимо провести профилактику тромбоза, так как в связи с оперативными вмешательствами у них существует повышенный риск тромботических и сосудистых осложнений, в особенности при наличии сопутствующего сердечно-сосудистого заболевания. Кроме того, следует принять особые меры предосторожности для пациентов со склонностью к тромбозам глубоких вен. Также при терапии препаратом Эпрекс® существует повышенный риск послеоперационных тромботических и сосудистых осложнений у пациентов с исходным уровнем гемоглобина >13 г/дл (8,1 ммоль/л). По этой причине пациентам с исходным уровнем гемоглобина >13 г/дл (8,1 ммоль/л) не следует проводить терапию препаратом Эпрекс®.
Предоперационная подготовка с забором аутологичной крови
Необходимо учитывать все особые указания и меры безопасности, связанные с программами забора аутологичной крови, в особенности в отношении регулярного восполнения объёма крови.
Особые указания
Применение препарата Эпрекс® у здоровых людей и людей, не страдающим анемией, опасно в связи с риском тромбоза при полиглобулии.
При развитии гипертонии следует исключить перегрузку жидкостью. Целесообразна строгая коррекция гипертонии с применением антигипертензивных препаратов, предпочтительно с применением сосудорасширяющих средств, до достижения «сухой массы», так как это может привести к дальнейшему повышению гематокрита и вязкости крови.
В таких случаях необходимо понизить дозу, прекратить терапию препаратом Эпрекс® или выполнить процедуру кровопускания, в особенности при превышении верхней границы нормы уровня гемоглобина или повышении уровня гемоглобина более чем на 2 г/дл в месяц (1,25 ммоль/л в месяц) (см. также рекомендации к дозировке в зависимости от показаний). Если несмотря на интенсивную терапию гипертонии возникает острая гипертоническая энцефалопатия с судорожными припадками или без них, необходимо прекратить терапию препаратом Эпрекс®. После этого концентрация гемоглобина понижается па 0,5 г/дл (0,3 ммоль/л) в неделю.
ЭЭГ и КТ помогают исключить другие причины судорожных припадков.
Возобновлять введение препарата Эпрекс® следует только под строгим контролем уровня гемоглобина и артериального давления до стабилизации уровня гемоглобина в диапазоне 10-12 г/дл (6,2-7,5 ммоль/л; гематокрита 0,30-0,35).
Игла предварительно наполненного шприца препарата Эпрекс® покрыта сухим натуральным каучуком (производное латекса), который может вызывать аллергические реакции у пациентов с чувствительностью к латексу.
Данный лекарственный препарат содержит менее 1 ммоль натрия (23 мг) на дозу, т. е. практически не содержит натрия.
Исследования влияния препарата Эпрекс® на способность управлять транспортными средствами и работать механизмами не проводились.
Раствор для внутривенного и подкожного введения, 20000 МЕ/0,5 мл.
По 0,5 мл в шприце из боросиликатного стекла (тип I).
Шприцы снабжаются устройством защиты иглы PROTECS™ для предотвращения ранения иглой после ее использования.
По 3 предварительно заполненных шприца вкладывается в контурную ячейковую упаковку из ПВХ.
По 2 контурно-ячейковых упаковки, содержащих 3 шприца, с инструкцией по применению помещают в картонную коробку.
Раствор для внутривенного и подкожного введения, 40000 МЕ/1 мл.
По 1,0 мл в шприце из боросиликатного стекла (тип I).
Шприцы снабжаются устройством защиты иглы PROTECS™ для предотвращения ранения иглой после ее использования.
По 1 предварительно заполненному шприцу вкладывается в контурную ячейковую упаковку из ПВХ.
По 1 контурно-ячейковой упаковке, содержащей 1 шприц с инструкцией по применению помещают в картонную коробку.
Руководство для самостоятельной инъекции лекарственного препарата Эпрекс®
В начале лечения лекарственный препарат Эпрекс®, как правило, вводится медицинским персоналом. Позже лечащий врач может предложить обучиться самостоятельному подкожному введению лекарственного препарата Эпрекс®.
Не используйте шприцы повторно.
При подкожном введении препарата Эпрекс® количество вводимого препарата обычно составляет не более миллилитра (1 мл) на однократную инъекцию.
Эпрекс® назначается отдельно, не разрешается смешивать его с другими растворами для инъекций.
Не встряхивайте шприцы с препаратом Эпрекс®. Продолжительное интенсивное встряхивание может повредить продукт. Если продукт подвергался сильному встряхиванию, не используйте его.
Как самостоятельно сделать инъекцию препарата с помощью предварительно заполненного шприца с устройством защиты. Шприцы снабжаются устройством защиты иглы PROTECS™ для предотвращения ранения иглой после ее использования (это также указано на картонной пачке).
Рисунок 1. Предварительно заполненный шприц
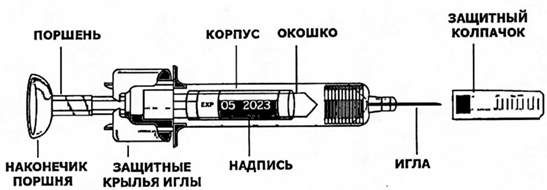
Достаньте шприц из холодильника. Раствор необходимо согреть до комнатной температуры. Обычно это занимает от 15 до 30 минут. Не снимайте защитный колпачок иглы, пока температура препарата не достигнет комнатной.
Проверьте шприц на правильность дозировки, срок хранения, отсутствие повреждений, а также прозрачность раствора и отсутствие признаков замораживания.
Подготовьте оборудование (предварительно заполненный шприц, спиртовые салфетки, пластырь).
Выберите место инъекции. Подходящими местами для инъекции является верхняя область бедра и передняя брюшная стенка, кроме околопупочной области. Ежедневно чередуйте места инъекций.
Вымойте руки. Очистите место инъекции тампоном с антисептиком для его дезинфекции.
Держите предварительно заполненный шприц за корпус шприца закрытой иглой вверх.
Не держите шприц за наконечник поршня, поршень, защитные «крылья» иглы или защитный колпачок иглы.
Не тяните за поршень.
Не снимайте защитный колпачок иглы с предварительно заполненного шприца до момента введения препарата.
Удалите колпачок иглы со шприца, взявшись за корпус шприца, и осторожно, не поворачивая, стяните колпачок иглы. Не нажимайте на поршень, не прикасайтесь к игле и не встряхивайте шприц.
Не трогайте защитные зажимы иглы (изображены в виде звездочек на рисунке 1) для предотвращения снятия защитного устройства иглы.
Сформируйте кожную складку между большим и указательным пальцами руки. Не стягивайте ее.
Введите иглу на всю длину.
Нажимайте на поршень до конца, для инъекции всего раствора. Нажимайте на него без усилия и равномерно, продолжая зажимать кожную складку. Устройство защиты иглы PROTECS™ не сработает, пока не будет введено все содержимое шприца. Вы услышите щелчок, когда устройство защиты иглы PROTECS™ будет активировано.
Когда поршень полностью войдет, извлеките иглу и расправьте кожную складку.
Медленно отнимите большой палец с поршня. Позвольте игле переместиться до полного ее покрытия защитной насадкой.
После того как игла извлечена из кожи, может быть небольшое кровотечение на месте инъекции. Это нормально. Вы можете прижать тампон с антисептиком к месту инъекции на несколько секунд после ее завершения.
Поместите использованный Вами шприц в безопасный контейнер.
Используйте только по одной дозе из каждого шприца. Если после инъекции в шприце остается раствор, все равно необходимо выбросить шприц, а не использовать его повторно.
При температуре от 2 до 8°C в защищенном от света месте. Не встряхивать и не замораживать.
Хранить в недоступном для детей месте.
Препарат Эпрекс® не содержит консервантов. Предварительно наполненные шприцы препарата предназначены только для одноразового использования с учетом рисков возможной микробной контаминации. Неиспользованные остатки лекарственного препарата должны быть утилизированы.
1,5 года. По истечении срока годности не применять.
По рецепту.
Производитель
Производство, упаковка и выпускающий
контролъ качества:
Силаг АГ, Швейцария, Шаффхаузен,
Хохштрассе, 201, 8200.
Держатель
регистрационного удостоверения, организация, принимающая претензии:
ООО «Джонсон & Джонсон»
121614, Россия, Москва, ул. Крылатская,
17/2
Контактные телефоны:
Тел.: (495) 755-83-57
Факс: (495) 755-83-58.
для инъекций, Белмедпрепараты, Беларусь • По рецепту

для инъекций, Белмедпрепараты, Беларусь • По рецепту
для инъекций, Белмедпрепараты, Беларусь • По рецепту