Ротатек вакцина ротавирусная, живая, пероральная, пентавалентная раствор: инструкция по применению
Содержание
- Лекарственная форма
- Состав
- Описание
- Фармакотерапевтическая группа
- Фармакологические свойства
- Показания к применению
- Способ применения и дозы
- Побочное действие
- Противопоказания
- Беременность и лактация
- Взаимодействие с другими лекарственными средствами
- Предупреждения
- Передозировка
- Несовместимость
- Упаковка
- Условия хранения
- Срок годности
- Условия отпуска из аптек
Лекарственная форма
РотаТек представляет собой живую, пероральную, пентавалентную вакцину для применения с целью предупреждения ротавирусного гастроэнтерита. Вакцина содержит 5 живых реассортантных ротавирусов. Штаммы родительских ротавирусов этих реассортантов являются человеческими и бычьими изолятами. Четыре реассортантных ротавируса экспрессируют один из внешних капсидных белков VP7 (серотип Gl, G2, G3 или G4) из родительских штаммов человеческих ротавирусов и белок прикрепления VP4 (серотип Р7[5]) из родительских штаммов бычьих ротавирусов. Пятый реассортантный вирус экспрессирует белок прикрепления VP4 (серотип Р1А[8]) из родительского штамма человеческого ротавируса и внешний капсидный белок VP4 (серотип G6) из родительского штамма бычьего ротавируса.
Состав
Одна доза (2,0 мл) содержит:
Активные ингредиенты: человеческие-бычьи ротавирусные реассортанты (живые), полученные в клетках Vero: Gl, G2, G3, G4 и Р1А[8].
Минимальные дозы реассортантов следующие:
| ротавирус тип G1 | не менее 2,2 х 106 инфицирующих единиц |
| ротавирус тип G2 | не менее 2,8 х 106 инфицирующих единиц |
| ротавирус тип G3 | не менее 2,2 х 106 инфицирующих единиц |
| ротавирус тип G4 | не менее 2,0 х 106 инфицирующих единиц |
ротавирус тип Р1А[8] не менее 2,3 х 106 инфицирующих единиц
Вспомогательные вещества: сахароза, натрия цитрат дигидрат, натрия дигидрофосфат моногидрат, натрия гидроксид, полисорбат 80, питательная среда (содержащая неорганические соли, аминокислоты и витамины), растворитель ротавируса.
Эта вакцина содержит 1080 мг сахарозы.
Описание
Прозрачная жидкость от светло-желтого до светло-желтого цвета с розовым оттенком.
Фармакотерапевтическая группа
Вирусные вакцины. Код АТС: J07BH02.
Фармакологические свойства
Фармакодинамика
Эффективность
В клинических исследованиях была продемонстрирована эффективность против гастроэнтерита, вызванного ротавирусами генотипов G1Р[8], G2P[4], G3P[8], G4P[8] и G9P[8].
В плацебо-контролированном исследовании эффективности и безопасности при ротавирусной инфекции защитная эффективность вакцины РотаТек оценивалась 2 способами:
1. У 5673 вакцинированных детей (2834 в группе вакцины) защитная эффективность определялась как снижение частоты случаев ротавирусного гастроэнтерита, вызванного вакцинными генотипами G (G1-G4), наблюдавшееся как минимум через 14 дней после применения третьей дозы вакцины и на протяжении первого полного ротавирусного сезона после вакцинации.
2. У 68 038 вакцинированных детей (34 035 в группе вакцины) защитная эффективность определялась как снижение частоты случаев госпитализации и посещений отделения неотложной помощи по причине ротавирусного гастроэнтерита, начиная с 14-го дня после применения третьей дозы.
Результаты этих анализов представлены в таблицах ниже.
| Снижение частоты возникновения ротавирусного гастроэнтерита на протяжении одного полного сезона после вакцинации (РотаТек n=2834) (% [95 % ДИ]) | ||||||
| Эффективность при любой степени тяжести заболевания,по генотипу ротавируса | ||||||
| Тяжелое* заболевание(G1-G4) | Заболевание любой степени тяжести (G1-G4) | G1 | G2 | G3 | G4 | G9 |
| 98,0 %[88,3, 100,0]+ | 74,0 %[66,8, 79,9]+ | 74,9 %[67,3, 80,9]+ | 63,4 %[2,6, 88,2]+ | 82,7 %[<0, 99,6] | 48,1 %[<0, 91,6] | 65,4 %[<0, 99,3] |
* Тяжелое заболевание как показатель >16/24 при использовании валидированной системы клинической оценки, основанной на интенсивности и длительности симптомов (лихорадка, рвота, диарея и изменения поведения).
+ Статистически значимое.
| Снижение частоты госпитализаций и посещений отделения неотложной помощи по причине ротавирусного гастроэнтерита на протяжении 2 лет после вакцинации(РотаТек n=34 035) (% [95 % ДИ]) | |||||
| G1-G4 | G1 | G2 | G3 | G4 | G9 |
| 94,5 %[91,2, 96,6]+ | 95,1 %[91,6, 97,1]+ | 87,6 %[<0, 98,5] | 93,4 %[49,4, 99,1]+ | 89,1 %[52,0, 97,5]+ | 100 %[69,6, 100]+ |
+ Статистически значимое.
Снижение частоты ротавирусного гастроэнтерита, вызванного генотипами G1-G4 на протяжении второго ротавирусного сезона после вакцинации, составило 88,0 % [95 % ДИ: 49,4, 98,7] для тяжелой формы заболевания и 62,6 % [95 % ДИ: 44,3, 75,4] для заболеваний любой степени тяжести.
Эффективность против ротавирусных генотипов G2P[4], G3P[8], G4P[8] и G9P[8] была основана на меньшем количестве случаев, чем против G1. Наблюдавшаяся эффективность против G2P[4] вероятнее всего была результатом G2-компонента вакцины.
В комбинированном ретроспективном анализе исследования REST и другого исследования фазы 3, эффективность вакцины против G1-, G2-, G3- и G4-серотипов ротавирусного гастроэнтерита (любой степени тяжести) составила 61,5 % [95 % ДИ: 14,2; 84,2] у детей в возрасте от >26 до ≤32 недель на момент введения третьей дозы.
Дополнительная часть исследования REST проводилась только в Финляндии. В финляндском дополнительном исследовании (FES) принимали участие 20 736 детей, которые ранее были зарегистрированы в исследовании REST. Этих детей наблюдали в течение 3 лет после вакцинации в исследовании FES.
В исследовании REST было 403 случая обращения за медицинской помощью (20 в группе вакцины и 383 в группе плацебо), связанных с G1-G4 и G9 RV гастроэнтеритом в протокольной популяции. Дополнительные данные, полученные в FES, увеличили общее количество на 136 обращений, включая 9 случаев в группе вакцины и 127 случаев в группе плацебо. В общем, 31 % и 25 % обращений в соответствующих группах произошли во время проведения FES.
Исходя из общих данных, полученных в REST и FES, за 3 года снижение частоты госпитализаций и визитов в отделение неотложной помощи по причине ротавирусного гастроэнтерита составило 94,4 % (95 % ДИ: 91,6, 96,2) для генотипов G1-G4, 95,5 % (95 % ДИ: 92,8, 97,2) для генотипа G1, 81,9 % (95 % ДИ: 16,1, 98,0) для генотипа G2, 89,0 % (95 % ДИ: 53,3, 98,7) для генотипа G3, 83,4 % (95 % ДИ: 51,2, 95,8) для генотипа G4 и 94,2 % (95 % ДИ: 62,2, 99,9) для генотипа G9. На протяжении 3-го года не было случаев обращения за медицинской помощью по причине ротавирусного гастроэнтерита в группе вакцины (n=3112) и был 1 случай (нетипируемый) в группе плацебо (n=3126).
Для обеспечения уровня и длительности защиты против ротавирусного гастроэнтерита, которые наблюдались в ходе клинических исследований, необходимо полностью завершить 3-дозовую схему вакцинации препаратом РотаТек (см. раздел 4.2). Однако анализ полученных результатов показал, что применение РотаТек приводит к уменьшению количества случаев заболевания ротавирусным гастроэнтеритом, тяжесть которого требует госпитализации и посещения отделения неотложной помощи, еще перед завершением 3-дозовой схемы вакцинации (например, приблизительно через 14 дней после применения первой дозы).
Эффективность у недоношенных детей
В исследовании REST вакцину РотаТек применяли приблизительно у 1000 детей, родившихся с гестационным возрастом от 25 до 36 недель. Эффективность РотаТек была сопоставима в этой группе детей и у детей, родившихся доношенными.
Постмаркетинговое наблюдательное исследование безопасности
В большом проспективном постмаркетинговом наблюдательном исследовании были проанализированы риски развития кишечной непроходимости и болезни Кавасаки у 85 150 детей, получавших 1 или более доз вакцины РотаТек (17 433 человеко-лет наблюдения).
На протяжении периода 0-30 дней после вакцинации не наблюдалось статистически значащего отличия в частоте развития непроходимости кишечника или болезни Кавасаки при сравнении с предполагаемыми фоновыми показателями. Кроме того, не было статистически значащего повышения риска возникновения таких побочных реакций на протяжении 0-30 дней периода последующего наблюдения по сравнению с одновременной контрольной группой детей, вакцинированных дифтерийной, столбнячной токсоидной, бесклеточной коклюшной (DTaP) вакциной, но не РотаТек (n=62 617, 12 339 человеко-лет последующего наблюдения). Было 6 подтвержденных случаев непроходимости кишечника у детей, вакцинированных РотаТек, и 5 случаев у детей группы одновременного контроля (относительный риск = 0,8, 95% ДИ: 0,22-3,52). Был один подтвержденный случай болезни Кавасаки среди детей, вакцинированных РотаТек, и один подтвержденный случай болезни Кавасаки в группе одновременного контроля DTaP (относительный риск = 0,7, 95% ДИ: 0,01-55,56). При проведении анализов общей безопасности не идентифицировано каких-либо специфических проблем, связанных с безопасностью.
Данные исследований эффективности
В постмаркетинговом наблюдательном исследовании, проводившемся в США, по информации крупной национальной базы данных, оценивалась эффективность вакцины РотаТек относительно предупреждения случаев госпитализации, посещений отделения неотложной помощи, а также обращений за амбулаторной медицинской помощью по причине заболевания ротавирусным гастроэнтеритом. В этом исследовании страховые случаи оценивались без активной регистрации или последующего наблюдения детей; не собирались данные непосредственно от детей или родителей. Случаи заболевания ротавирусным гастроэнтеритом были идентифицированы с использованием специфического диагностического кода для ротавирусных заболеваний. Было 33 140 детей, вакцинированных 3 дозами РотаТек, и 26 167 детей в параллельной контрольной группе, вакцинированных дифтерийной, столбнячной токсоидной, бесклеточной коклюшной (DTaP) вакциной, но не РотаТек. Последующий мониторинг проводился на протяжении 2 ротавирусных сезонов и начинался, самое позднее, через 14 дней после применения третьей дозы в каждой из групп или вначале каждого сезона, а плановое последующее наблюдение длилось до окончания каждого из сезонов. Эффективность вакцины против ротавирусного гастроэнтерита составила 100 % [95 % ДИ: 87, 100] относительно госпитализаций и посещений отделения неотложной помощи, и 96 % [95 % ДИ: 76, 100] - относительно обращений за амбулаторной медицинской помощью. Эффективность вакцины (госпитализация и неотложная помощь) против заболевания гастроэнтеритом, независимо от причины возникновения (ротавирус или другая причина), составила 59 % [95 % ДИ: 47, 68].
В наблюдательном исследовании, которое проводилось на северо-западе Франции и было сфокусировано на детях в возрасте до 2 лет, в общем, 4684 детей получили как минимум 1 дозу вакцины РотаТек, а применение полного курса вакцины из 3 доз достигло 47,1 %. Все дети, которые обращались за медицинской помощью с симптомами гастроэнтерита, были включены в исследование; для идентификации ротавируса проводили анализ кала. Из 1895 детей, вакцинированных по полной схеме, один ребенок был госпитализирован с подтвержденным ротавирусным гастроэнтеритом, по сравнению с 47 госпитализированными с подтвержденным ротавирусным гастроэнтеритом из 2102 невакцинированных детей. Некорректная оценка эффективности РотаТек в предупреждении госпитализаций по причине ротавирусного гастроэнтерита у детей в возрасте до 2 лет составила 98 % [95 % ДИ: 83, 100].
Фармакокинетика
Для вакцин не требуется оценки фармакокинетических свойств.
Иммунобиологические свойства
Иммунологический механизм, по которому РотаТек защищает от ротавирусного гастроэнтерита, полностью не изучен. В настоящее время для вакцин против ротавируса иммунологического соотношения защиты не идентифицировано. В исследованиях фазы III от 92,5 % до 100 % реципиентов вакцины РотаТек достигли значительного повышения антиротавирусных IgA в сыворотке крови после введения трех доз. Вакцина индуцирует иммунный ответ (например, появление сывороточных нейтрализующих антител) к 5 белкам человеческих ротавирусов, представленных этими реассортантами (Gl, G2, G3, G4 и Р[8]).
Показания к применению
РотаТек показан для активной иммунизации детей в возрасте от 6 недель до 32 недель с целью предупреждения гастроэнтерита, вызванного ротавирусной инфекцией.
РотаТек следует применять в соответствии с официальными рекомендациями.
Способ применения и дозы
Дозировка
Дети в возрасте от 0 до 6 недель
РотаТек не показан для применения в этой подгруппе детей.
Безопасность и эффективность применения РотаТек у детей в возрасте от 0 до 6 недель не установлены.
Дети в возрасте от 6 недель до 32 недель
Следует применять 3 дозы вакцины РотаТек.
Первую дозу следует применять в возрасте 6 недель, и не позже чем в возрасте 12 недель. РотаТек можно применять у недоношенных детей при условии, что период гестации равен, как минимум, 25 неделям. Эти дети должны получать первую дозу РотаТек не ранее чем через 6 недель после рождения.
Последующие дозы следует применять с интервалом между ними не менее 4 недель.
Все три дозы должны быть введены к возрасту 32 недель.
Желательно, чтобы курс вакцинации был завершен к возрасту 20-22 недели.
Если необходимо, третью (последнюю) дозу можно ввести в возрасте до 32 недель.
Поскольку нет данных относительно взаимозаменяемости РотаТек с другими ротавирусными вакцинами, рекомендовано, чтобы дети, которые получали РотаТек для первой иммунизации против ротавируса, продолжали получать дозы этой же вакцины в дальнейшем.
Если замечено или подозревается, что ребенок проглотил не всю дозу вакцины (например, сплюнул или отрыгнул вакцину), можно разово применить замещающую дозу на том же визите вакцинации, хотя такое применение не изучалось в клинических исследованиях. Если вновь возникает такая же проблема, не следует применять дополнительную замещающую дозу.
Не рекомендовано применение дополнительных доз после завершения 3-дозовой схемы вакцинации.
Дети в возрасте от 33 недель до 18 лет
РотаТек не показан для применения в этой подгруппе детей.
Способ применения
Только для перорального применения. Вакцину следует принимать через рот, не смешивая с какими-либо другими вакцинами или растворами. Не разводить.
РотаТек НЕЛЬЗЯ ВВОДИТЬ В ВИДЕ ИНЪЕКЦИИ.
РотаТек можно применять независимо от приема пищи, жидкости или грудного молока. а.
Для применения вакцины:

Разорвите защитный пакет и достаньте пластиковый дозированный тюбик.
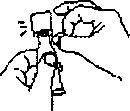
Держа тюбик вертикально, постучите по отвинчивающемуся колпачку, чтобы удалить жидкость из дозирующего наконечника.
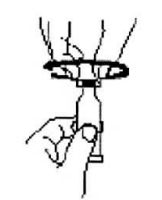
Откройте дозированный тюбик двумя легкими движениями:
1. Проколите дозирующий наконечник, повернув колпачок до отказа по часовой стрелке.
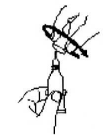
2. Поверните колпачок против часовой стрелки и снимите его.
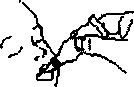
Введите дозу, осторожно выдавливая жидкость в рот ребенка в направлении внутренней стороны щеки, пока дозированный тюбик не станет пустым. (В наконечнике дозатора может остаться последняя капля.)
Выбросьте пустой дозированный тюбик и колпачок в соответствующий контейнер для биологических отходов, согласно местным правилам.
РотаТек следует вводить как можно скорее после извлечения из холодильника. При хранении вне холодильника, при температуре 25°С или ниже, введение может быть отложено до 48 часов. После этого вакцину нужно выбросить в специально предназначенные контейнеры для биологических отходов, в соответствии с местными правилами.
Побочное действие
Краткая характеристика профиля безопасности
У детей, принимавших участие в трех плацебо-контролированных клинических исследованиях (n=6130 реципиентов РотаТек и 5560 реципиентов плацебо), оценивали РотаТек относительно всех побочных эффектов, возникших на протяжении 42 дней после вакцинации, независимо от факта одновременного применения других вакцин для детей. В общем, у 47 % детей, которым вводили РотаТек, наблюдались побочные реакции, по сравнению с 45,8 % детей, получавших плацебо. Наиболее часто сообщавшимися побочными реакциями, возникавшими чаще, чем при применении плацебо, были: пирексия (20,9 %), диарея (17,6 %) и рвота (10,1 %).
Серьезные побочные реакции оценивали у всех участников (36 150 реципиентов РотаТек и 35 536 реципиентов плацебо) трех клинических исследований на протяжении 42 дней после применения каждой дозы. Общая частота этих серьезных побочных реакций составила 0,1 % у реципиентов РотаТек и 0,2 % - у реципиентов плацебо.
Таблица побочных реакций
Побочные реакции, часто наблюдавшиеся в клинических исследованиях в группе применения вакцины, перечислены ниже по классам систем органов и по частоте. Исходя из объединенных данных трех клинических исследований, в которых 6130 детей получили РотаТек и 5560 получили плацебо, перечисленные побочные реакции чаще (на 0,2-2,5 %) наблюдались у реципиентов РотаТек, чем у реципиентов плацебо. Побочные реакции, наблюдавшиеся в ходе постмаркетингового применения (включая спонтанные сообщения), выделены курсивом.
Частота определена как: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10 000, <1/1000), очень редко (<1/10 000), неизвестно (невозможно определить по имеющимся данным).
| Побочные реакции после применения РотаТек в клинических исследованиях, а также побочные реакции, о которых сообщалось в постмаркетинговый период | ||
| Класс систем органов | Частота | Побочные реакции/явления |
| Инфекции и инвазии | часто | инфекции верхних отделов респираторного тракта |
| нечасто | ринофарингит, отит среднего уха | |
| Нарушения со стороны иммунной системы | неизвестно | анафилактическая реакция* |
| Нарушения со стороны респираторного тракта, органов грудной клетки и средостения | редко | бронхоспазм |
| Нарушение со стороны ЖКТ | очень часто | диарея, рвота |
| нечасто | Гематохезия+, боль в верхней области живота | |
| очень редко | кишечная непроходимость α | |
| Нарушения со стороны кожи и подкожных тканей | нечасто | сыпь |
| редко | крапивница+ | |
| неизвестно | ангионевротический отек * | |
| Нарушения общего состояния и связанные со способом применения препарата | очень часто | пирексия |
| неизвестно | раздражительность ** | |
+ Эти побочные реакции были идентифицированы в ходе постмаркетингового наблюдения.
Частота оценивалась, исходя из соответствующих клинических исследований.
α Частота оценивалась по данным наблюдательного исследования.
* см. раздел «предупреждения».
** Побочные реакции в постмаркетинговом периоде (частоту невозможно установить по имеющимся данным).
Описание отдельных побочных реакции
О болезни Кавасаки сообщалось у 5 из 36 150 реципиентов вакцины (<0,1 %) и у 1 из 35 536 реципиентов плацебо (<0,1 %) с показателем относительного риска (RR) 4,9 [95 % ДИ: 0,6-239,1] (статистически незначимое). Не наблюдалось повышенного риска развития болезни Кавасаки у детей, получавших РотаТек, в большом постмаркетинговом наблюдательном исследовании.
Кишечная непроходимость
Данные наблюдательных исследований безопасности, проводившихся в нескольких странах, указывают на то, что применение ротавирусных вакцин сопровождается повышенным риском развития кишечной непроходимости (до 6 дополнительных случаев на 100 000 детей на протяжении 7 дней вакцинации). Существует ограниченное количество данных, указывающих на меньшее увеличение риска после второй дозы. Исходная частота кишечной непроходимости у детей в возрасте младше 1 года в этих странах варьировала от 33 до 101 на 100 000 детей в год. Остается неизвестным, влияет ли применение ротавирусных вакцин на общую частоту кишечной непроходимости при более длительных периодах последующего наблюдения (см. «Предупреждения»).
Другие отдельные группы
Апноэ у глубоко недоношенных детей (рожденные в возрасте ≤ 28 недель гестации).
В постмаркетинговый период сообщалось о гастроэнтерите с выделением вакцинного вируса с калом у детей с тяжелым комбинированным иммунодефицитом.